
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:不详 题型:单选题
| A.以焦炭和水制取水煤气分离出氢气 |
| B.利用太阳能直接使水分解产生氢气 |
| C.用铁和盐酸反应放出氢气 |
| D.由热电站提供电力电解水产生氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.C3H8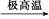 3C+4H2 3C+4H2 |
B.C3H8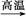 C3H6+H2 C3H6+H2 |
C.C3H8+6H2O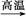 3CO2+10H2 3CO2+10H2 |
D.2H2O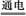 2H2↑+O2↑ 2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②④⑤③① | B.③②④①⑤ |
| C.③④②⑤① | D.②④③⑤① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.精制的饱和食盐水进入阳极室 |
| B.纯水(加少量NaOH)进入阴极室 |
| C.阴极产物为NaOH和氢气 |
| D.电解槽的阳极用金属铁网制成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.海水和蒸馏水所溶解的CO2一样多 |
| B.海水中溶解的CO2较多 |
| C.海水中的c(HCO3-)较大 |
| D.海水中的c(CO32-)较大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
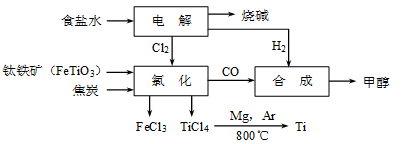
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
 CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
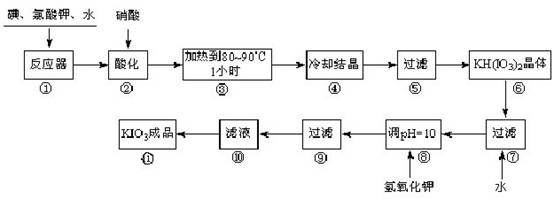
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com