
| A、△H1>0,△H3<0 |
| B、△H2>0,△H4>0 |
| C、△H1=△H2+△H3 |
| D、△H3=△H4+△H5 |
| 2 |
| 3 |
| 1 |
| 2 |
| 1 |
| 3 |
| 2 |
| 3 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含Mg2+、Al3+、Cl-,不含Na+、NH4+ |
| B、一定含Na+、Mg2+、Cl-,不含NH4+,可能含有Al3+ |
| C、c(Cl-)为4.0mol/L,c(Al3+)为1.0mol/L |
| D、c(Mg2+)为1.0mol/L,c(Na+)为0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
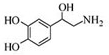 去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示,下列说法正确的是( )
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示,下列说法正确的是( )| A、每个去甲肾上腺素分子中含有3个酚羟基 |
| B、每个去甲肾上腺素分子中含有1个手性碳原子 |
| C、1mol去甲肾上腺素最多与2mol Br2发生取代反应 |
| D、去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用酸性高锰酸钾即可鉴别苯酚溶液,2,4-己二烯和甲苯 |
B、按系统命名法化合物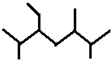 的名称为:2,5,6-三甲基-3-乙基庚烷 的名称为:2,5,6-三甲基-3-乙基庚烷 |
C、新型解热镇痛抗炎药贝诺酯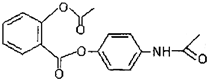 在酸性条件下完全水解可以得到3种有机物 在酸性条件下完全水解可以得到3种有机物 |
D、β-月桂烯的结构如图 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na | B、Mg | C、Al | D、Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
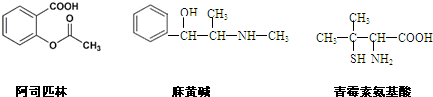
| A、三种有机物都能发生酯化反应 |
| B、阿司匹林能与NaOH溶液反应生成可溶性有机物 |
| C、麻黄碱的分子式是C10H15NO,苯环上的一氯代物有3种 |
| D、青霉素氨基酸不能与盐酸反应,但能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
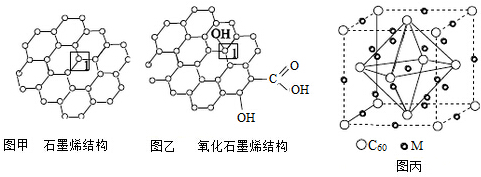
查看答案和解析>>
科目:高中化学 来源: 题型:
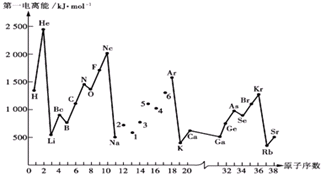
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com