
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
| c(NO2) |
| c(NO) |



科目:高中化学 来源: 题型:
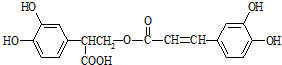 ,以邻苯二酚为原料合成迷迭香酸的路线为:
,以邻苯二酚为原料合成迷迭香酸的路线为:
| A、有机物A分子中所有原子一定在同一平面上 |
| B、有机物C在浓硫酸催化下水解的一种产物是B |
| C、有机物B可以发生取代、加成、消去、氧化反应 |
| D、1 mol迷迭香酸分别与足量的NaOH溶液、浓溴水反应,最多可消耗NaOH、Br2均为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
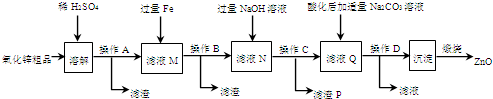
查看答案和解析>>
科目:高中化学 来源: 题型:
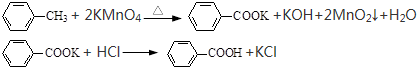

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气通入碘化钾溶液:Cl2+I-=Cl-+I2 |
| B、稀盐酸与氨水混合:H++OH-=H2O |
| C、碳酸钠溶液与稀盐酸混合:CO32-+2H+=H2O+CO2↑ |
| D、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
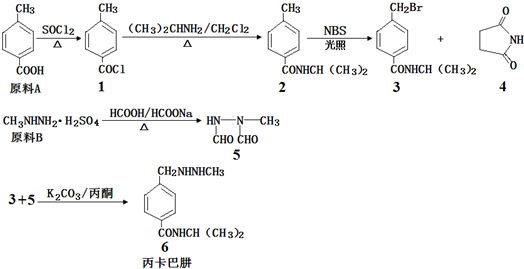
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
| B、蔗糖是高分子化合物,其水解产物能发生银镜反应 |
| C、淀粉和纤维素都可以作为工业上生产葡萄糖的原料 |
| D、蛋白质溶液中加入BaCl2溶液析出沉淀,此过程叫盐析 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com