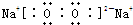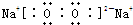甲醇可作为燃料电池的原料.以CH
4和H
2O为原料,通过下列反应反应来制备甲醇.
反应I:CH
4 (g)+H
2O (g)=CO (g)+3H
2 (g)△H=+206.0kJ?mol
-1反应II:CO (g)+2H
2 (g)=CH
3OH (g)△H=-129.0kJ?mol
-1(1)CH
3OH (g)和H
2(g)反应生成CH
4(g)与H
2O(g)的热化学方程式为
CH3OH (g)+H2(g)=CH4(g)+H2O(g)△H=-77.0 kJ?mol-1
CH3OH (g)+H2(g)=CH4(g)+H2O(g)△H=-77.0 kJ?mol-1
.
(2)将1.0mol CH
4和2.0mol H
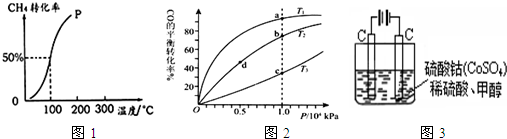
2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH
4的转化率与温度的关系如图1.
①假设100℃时达到平衡所需的时间为5min,则用H
2表示该反应的平均反应速率为
0.03 mol?L-1?min-1
0.03 mol?L-1?min-1
.
②100℃时反应I的平衡常数为
2.25×10-2
2.25×10-2
.
③可用来判断该反应达到平衡状态的标志有
A D
A D
.(填字母)
A.CO的含量保持不变
B.容器中CH
4浓度与CO浓度相等
C.容器中混合气体的密度保持不变
D.3V
正(CH
4)=V
逆(H
2)
(3)按照反应II来生成甲醇,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
C
C
A.温度:T
1>T
2>T
3B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数:K(a)>K(c); K(b)=K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(4)工业上利用甲醇制备氢气的常用方法之一为:甲醇蒸汽重整法.该法中的一个主要反应为CH
3OH(g)?CO(g)+2H
2(g),此反应能自发进行的原因是
该反应是一个熵增的反应
该反应是一个熵增的反应
.
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co
2+氧化成Co
3+,然后以Co
3+做氧化剂把水中的甲醇氧化成CO
2而净化.实验室用图3装置模拟上述过程:
①写出阳极电极反应式
Co2+-e-=Co3+
Co2+-e-=Co3+
.
②写出除去甲醇的离子方程式
6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+
6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+
.
③若3图装置中的电源为甲醇-空气-KOH溶液的燃料电池,则电池负极的电极反应式为:
CH3OH-6e-+8OH-═CO32-+6H2O
CH3OH-6e-+8OH-═CO32-+6H2O
.