
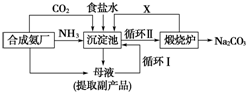
分析 (1)将二氧化碳和氨气、食盐水加入沉淀池中,发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,得到的沉淀在煅烧炉中发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,从而得到Na2CO3,副产品是氯化铵,此法为侯氏制碱法;
(2)沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;
(3)煅烧炉中碳酸氢钠分解生成碳酸钠、二氧化碳和水,二氧化碳可以循环使用;
(4)分离固体和溶液采用过滤方法;
(5)氯离子与银离子反应生成不溶于硝酸的氯化银沉淀,据此检验氯离子存在;
(6)向母液中通氨气,溶液中的铵根离子浓度增大有利于氯化铵晶体析出,可以是碳酸氢钠转化为溶解度更大的碳酸钠,提高氯化铵的纯度.
解答 解:将二氧化碳和氨气、食盐水加入沉淀池中,发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,得到的沉淀在煅烧炉中发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,从而得到Na2CO3,副产品是氯化铵,此法为侯氏制碱法.
(1)该法为侯德榜制碱法(或联合制碱法);副产品氯化铵可以用作氮肥,
故答案为:侯德榜制碱法(或联合制碱法); 用做农作物的化肥;
(2)沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;过滤;
(3)煅烧炉中碳酸氢钠分解生成碳酸钠、二氧化碳和水,二氧化碳可以循环使用,所以X为二氧化碳,分子式为CO2;
故答案为:CO2;
(4)分离固体和溶液采用过滤方法,所以从沉淀池中取出沉淀的操作是过滤;
故答案为:过滤;
(5)氯离子与银离子反应生成不溶于硝酸的氯化银沉淀,所以检验氯离子方法为:取少量试样溶于水后,再滴加硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
故答案为:硝酸酸化的硝酸银溶液;
(6)氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来,故a正确;通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度所以选项c正确,选项b错误,
故答案为:ac.
点评 本题以侯氏制碱工业为载体考查物质的制备,明确侯氏制碱法原理,明确流程图中发生的反应、物质分离提纯方法是解本题关键,侧重考查学生分析判断能力,注意向氯化钠溶液中通入氨气和二氧化碳的先后顺序.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 9:1 | B. | 10:1 | C. | 1:10 | D. | 9:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2CH3OH(1)+3O2(g)═2CO2(g)+2H2O(g)△H=-1478KJ/mol,则CH3OH(1)的燃烧热为739KJ/mol | |
| B. | 若P4(白磷,s)═4P(红磷,s)△H<0,则红磷比白磷稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.3KJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.65KJ的热量 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
温度 盐 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
| A. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,滴加氢氧化钠溶液时Fe2+先产生沉淀 | |
| B. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,若除去混合溶液中的Fe2+、Fe3+,可先加入稀硝酸,再加入氧化铜调节溶液的pH的范围为3.2-4.7 | |
| C. | 相同温度下,Ksp[(Cu(OH)2)>Ksp[(Fe(OH)2) | |
| D. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,除去混合溶液中的Fe2+、Fe3+,可加入足量的铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 在t℃时,AgCl(s)+Br-(aq)═AgBr(s)+Cl-(aq)的平衡常数 K≈816 | |
| C. | 图中a点对应的是AgBr的不饱和溶液 | |
| D. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不变,说明反应已达平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体混合物中C%可能增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
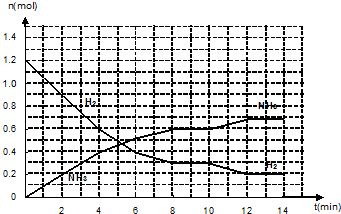
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙中的热化学方程式为2C(g)?A(g)+3B(g);△H=+4Q2/3kJ/mol | |
| B. | 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正大于v逆 | |
| C. | 在该条件下,反应2C(g)?A(g)+3B(g)的平衡常数为9×1.52(mol/L)2 | |
| D. | 乙中C的转化率为25% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com