
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:实验题
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应2H2O2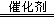 2H2O+O2↑可制备氧气。
2H2O+O2↑可制备氧气。
① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的___(填“深”或“浅”),其原因是_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
B.500℃、30MPa 下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·m
2NH3(g) △H=-38.6kJ·m ol-1
ol-1
C.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2 (g);△H=-283.0 kJ/mol
D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上教学质检化学试卷(解析版) 题型:实验题
某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝 ,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁
,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁 和铜的实验方案.(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)
和铜的实验方案.(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)

(1)操作a的名称为 ,所需要的玻璃仪器为 。
(2)固体E的成分为 ,加入的试剂④为稀硫酸,发生的化学方程式为 。
(3)加入试剂①的目的是 。
(4)从溶液D和溶液G中得到FeSO4•7H2O晶体的操作为 、冷却结晶、过滤、 、干燥。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上教学质检化学试卷(解析版) 题型:选择题
下列实验方案设计中,可行的是
A. 加稀盐酸后过滤,除出去混在铜粉中的少量镁粉和铝粉
B. 用萃取的方法分离汽油和煤油
C. 用溶解、过滤的方法分离KNO3和NaCl固体的混合物
D. 将O2和H2的混合物通过灼热的氧化铜,以除去其中的H2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,Y原子P能级上有2个未成对电子,Z原子比X原子的核外电子数多4。下列说法正确的是
A. X、Y、Z的电负性大小顺序是Z<Y<X
B. WY2分子中σ键与π键的数目之比是2∶1
C. W、X、Y、Z的原子半径大小顺序是X>Y>Z>W
D. W、Z形成的分子的空间构型是三角锥形
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:填空题
Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如 下图:
下图: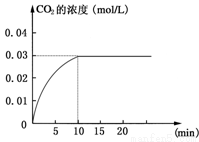
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=________ mol/L,该温度下的平衡常数K 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___________,已知Ksp(
为:___________,已知Ksp( AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com