
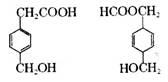
对右图两种化合物的结构或性质描述正确的是
A.互为同分异构体
B.均能与Na反应且产物相同
C.均可发生取代反应和加成反应
D.分子中共平面的碳原子数相同
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
下列各组微粒具有相同的质子数和电子数的是( )
A.OH-、H2O、F- B.NH3、NH4+、NH2-
C.H3O+、NH4+、NH2- D.HCl、F2、H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
铜锌合金的颜色酷似金的颜色,所以近来用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。要检验市面上的金首饰是否为纯金或者真金,可取样品与一种试剂进行反应,根据现象即可判断 ,所取的试剂不能是
A.硫酸 B.“王水” C.盐酸 D.硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
硫及其部分化合物的转化关系如图所示。
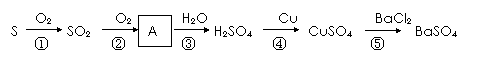 |
(1)硫单质俗称硫黄,通常状况下硫单质的颜色为 ;
(2)SO2可以使品红溶液褪色,说明SO2具有 (填“漂白性”或“氧化性”);
(3)化合物A的化学式为 ;
(4)反应⑤的离子方程式为 ;
(5)反应④中,当32g Cu完全反应时,被还原的H2SO4的物质的量为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
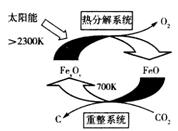 (1)科学家提出由CO2制取C的太阳能工艺如右图所示。
(1)科学家提出由CO2制取C的太阳能工艺如右图所示。
①若“重整系统”发生的反应中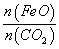 =6,则FexOy的化学式为______________。
=6,则FexOy的化学式为______________。
②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:
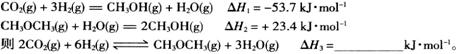
①一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小
 b.H2的转化率增大
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中的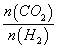 值变小
值变小
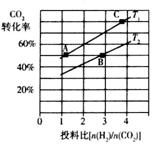
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的转化率如右图所示。
T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率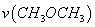 =______;KA、KB、KC三者之间的大小关系为______________。
=______;KA、KB、KC三者之间的大小关系为______________。
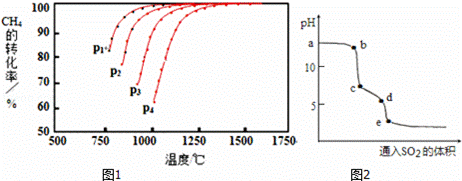
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH4+)___c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O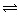 NH3·H2O+H2CO3的平衡常数K=____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5mol·L-1,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5mol·L-1,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
香港《南华早报》2012年11月2日报道:由中航沈阳飞机工业集团制造的新型
隐形战机歼-31的原型机10月31日试飞成功。用于制造隐形飞机的物质具有吸收
微波的功能,其主要成分的结构如图,关于该分子的说
法正确的有( )
A.分子中含有碳碳双键,属于烯烃
B.从碳骨架形状分析,应该属于环状烃
C.含硫元素该分子属于无机化合物
D.该分子即可以使溴水褪色,也可以使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法中不正确的是 ( )
A.甲烷与氯气在光照条件下的反应和乙酸与乙醇生成乙酸乙酯的反应均属于
取代反应
B.顺-2-丁烯和反-2-丁烯的熔、沸点不相同
C.C4H9Br的同分异构体有3种
D.乙烯、苯分子中的所有原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来大气问题受到人们越来越多的关注.按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义.在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图1.
则p1、p2、p3、p4由大到小的顺序 P4>P3>P2>P1 ,该反应的正反应是 吸热 (填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K= 1024 .
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJ•mol﹣1
CH4(g)+2NO2 (g)=N2(g)+CO2(g)+2H2O(g)△H3
则△H3= ﹣867kJ•mol﹣1 ,如果三个反应的平衡常数依次为K1、K2、K3,则K3= 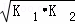 (用K1、K2表示)
(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol•L﹣1NaOH溶液通入SO2过程中的pH变化曲线如图2所示.
①ab段发生反应的离子方程式为 SO2+2OH﹣=SO32﹣+H2O .
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为 c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣) ,如果NaHSO3的水解平衡常数Kh=1×10﹣12mol•L﹣1,则该温度下H2SO3的第一步电离平衡常数Ka= 10﹣2mol•L﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com