
| A. | Cu$\stackrel{{H}_{2}S{O}_{4}}{→}$CuSO4$\stackrel{Ba(N{O}_{3})_{2}}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{{O}_{2}}{→}$CuO$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 | |
| C. | Cu$\stackrel{{O}_{2}}{→}$CuO$\stackrel{{H}_{2}O}{→}$Cu(OH)2$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 | |
| D. | Cu$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 |
分析 绿色化学要求尽可能地利用原料并保证生产过程无污染,且在经济、环保和技术上有设计可行性,据此解答.
A、铜与硫酸反应生成二氧化硫,会有污染物生成;
B、Cu生成CuO,再生成硝酸铜,整个过程中无污染物的生成;
C、将CuO转化为Cu(OH)2,在技术上难以实现;
D、铜与硝酸反应生成一氧化氮或者二氧化氮,都会有污染物生成;
解答 解:A、铜与硫酸反应生成二氧化硫,会有污染物生成,不符合“绿色化学”的思想,故A错误;
B、Cu生成CuO,再生成硝酸铜,整个过程中无污染物的生成,符合“绿色化学”的思想,故B正确;
C、将CuO转化为Cu(OH)2,在技术上难以实现,且增加了步骤,不符合“绿色化学”中经济性的要求,故C错误;
D、铜与硝酸反应生成一氧化氮或者二氧化氮,都会有污染物生成,不符合“绿色化学”的思想,故D错误;
故选:B.
点评 本题通过生活环境污染及治理的绿色化学问题考查了硝酸、硫酸和铜反应的实质问题,本题难度不大,注意反应的产物即可.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:解答题
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L水中含有1molH2SO4 | B. | 1L溶液中含有1molH+ | ||
| C. | 1LH2SO4溶液中含98g H2SO4 | D. | 将98g H2SO4溶于1L水配成溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一定含有Al,其质量为4.5g | |
| B. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定不含FeCl2,可能含有MgCl2和AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
.某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 132 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 与水反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
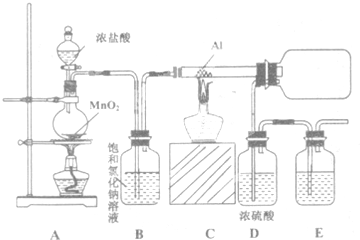
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
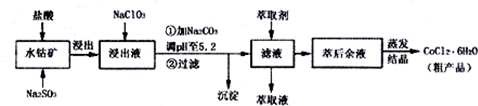
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
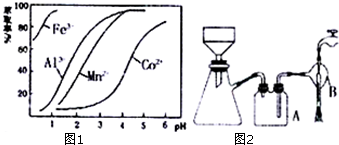
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应的正反应是吸热反应 | |
| B. | 100℃时,向体积为V1L的恒容密闭容器中充入2mol CO和4mol H2,达到平衡时,CO的转化率为40%,则V1=12 | |
| C. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CO的体积分数为50% | |
| D. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CH3OH(g)的体积分数为62.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高一定的温度 | |
| B. | 加入100 mL 0.1 mol•L-1的醋酸溶液 | |
| C. | 加入少量的0.5 mol•L-1的硫酸 | |
| D. | 加入少量的1 mol•L-1的NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com