




| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
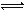 Z(g)����60s�ﵽƽ�⣬����0.3 mol Z��������ȷ����( )
Z(g)����60s�ﵽƽ�⣬����0.3 mol Z��������ȷ����( )| A��60s����XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.001 mol/(L��s) |
| B�������������Ϊ20 L��Z��ƽ��Ũ�ȱ�Ϊԭ����1/2 |
| C��������ѹǿ��������Y��ת���ʼ�С |
| D���������¶ȣ�X�������������������Ӧ��DH��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A������Fe2O3��Ͷ���� |
| B������������������䣬����H2�������� |
| C������N2������������ѹǿ���� |
| D������N2����������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3(g��;
2NH3(g��;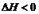 ,10minʱ�����ʵ�Ũ�Ȳ��ٱ仯�����NH3�����ʵ���Ϊ0.4mol��
,10minʱ�����ʵ�Ũ�Ȳ��ٱ仯�����NH3�����ʵ���Ϊ0.4mol��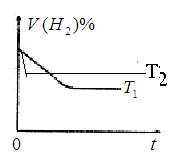

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2(g)+H2(g)��CO2��ƽ�����ʵ���Ũ��c(CO2)���¶�T�Ĺ�ϵ��ͼ��ʾ������˵��������ǣ� ��
CO2(g)+H2(g)��CO2��ƽ�����ʵ���Ũ��c(CO2)���¶�T�Ĺ�ϵ��ͼ��ʾ������˵��������ǣ� ��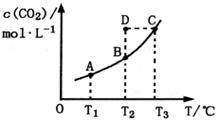
A����ӦCO(g)+H2O(g) CO2(g)+H2(g)����H>0 CO2(g)+H2(g)����H>0 |
| B����T2ʱ������Ӧ����״̬D����һ����v��<v�� |
| C��ƽ��״̬A��C��ȣ�ƽ��״̬A��c(CO)С |
| D����ѹ�ܱ�������ͨ��1mol CO(g)��1mol H2O(g)������������Ӧ������Ӧ�ﵽƽ�����������������ʱ����ͨ��1mol H2O(g)��1mol CO(g)�Ļ�����壬v����v����Ӧ������ʱ��t�仯��ʾ��ͼ���¡� |
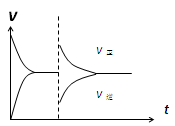
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 nC��s��+D��g����ƽ�⡣��ά���¶Ȳ��䣬����ѹǿ����û�������ƽ����Է����������䣬�������ж���ȷ����( )
nC��s��+D��g����ƽ�⡣��ά���¶Ȳ��䣬����ѹǿ����û�������ƽ����Է����������䣬�������ж���ȷ����( )| A�������������䣬����ѹǿ��ƽ�ⲻ�����ƶ� |
| B�������������䣬����ѹǿ�������������������� |
| C���÷�Ӧʽ��nֵһ��Ϊ2 |
D��ԭ�������A��B�����ʵ���֮��Ϊ2:1����  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧƽ���������ǿ��淴Ӧ |
| B�����淴Ӧ�ﵽ��ѧƽ��״̬ʱ�������淴Ӧ���ʶ�Ϊ0 |
| C�����淴Ӧ�ﵽ��ѧƽ��״̬ʱ��v������=v���棩��0 |
| D�����淴Ӧ�ﵽ��ѧƽ��״̬ʱ������ɳɷ�Ũ�ȱ��ֲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)��D(g)����һ���¶ȡ�����̶����ܱ������н��У�������������˵��������Ӧ�ﵽƽ��״̬����
2C(g)��D(g)����һ���¶ȡ�����̶����ܱ������н��У�������������˵��������Ӧ�ﵽƽ��״̬�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
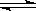 2SO3.5min��ﵽƽ��,�����������SO31.6mol.
2SO3.5min��ﵽƽ��,�����������SO31.6mol.| A��v����(SO2)=v����(SO3) | B����������ƽ����Է����������ٸı� |
| C�����������ܶȲ��ٸı� | D������������������ʵ������ٱ仯 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com