
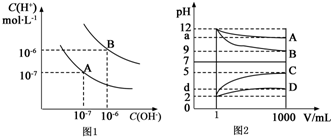
分析 I.(1)结合图示根据水的离子积表达式Kw=c(H+)•c(OH-)及氢氧根离子浓度计算出100℃水的离子积;
(2)设出氢氧化钡溶液、盐酸溶液的体积,然后根据溶液的pH列式计算出二者的体积比;
II.根据图象曲线变化可知,溶液从1mL稀释到1000mL,B的pH减小了3,C的pH增大了3,AD的pH变化小于3,说明A为一水合氨,B为NaOH,C为HCl,D为醋酸,
(1)根据以上分析进行解答;
(2)氨水与盐酸反应生成氯化铵和水,据此写出反应得到离子方程式;
(3)醋酸与氢氧化钠溶液反应生成醋酸钠,醋酸根离子部分水解,溶液显示碱性,结合电荷守恒判断各离子浓度大小;
(4)a.根据CH3COOH溶液中的电荷守恒判断;
b.0.1mol/L 的CH3COOH 溶液加水稀释,氢离子浓度减小,结合水的离子积不变分析氢氧根离子浓度的变化;
c.加入少量CH3COONa固体,溶液中醋酸根离子的浓度增大,则平衡逆向移动;
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合,醋酸为弱酸,则混合液中醋酸过量,溶液显示酸性.
解答 解:(1)根据图象可知,A点25℃时,c(H+)=c(OH-)=1×10-7mol/L,Kw=c(H+)•c(OH-)=1×10-7×1×10-7=10-14,
100℃时,c(H+)=c(OH-)=1×10-6mol/L,Kw=c(H+)•c(OH-)=1×10-6×1×10-6=10-12,
故答案为:1×10-12;
(2)设氢氧化钡容溶液的体积为xL,盐酸的体积为y,pH=8的Ba(OH)2溶液,溶液中c(OH-)=1×10-6mol/L,pH=5的稀盐酸溶液中c(H+)=1×10-5mol/L,
欲使混合溶液pH=7,必须满足n(H+)=n(OH-),即:1×10-6mol/L×xL=1×10-5mol/L×yL,解得x:y=10:1,
故答案为:10:1;
II.(1)根据图象曲线变化可知,溶液从1mL稀释到1000mL,B的pH减小了3,C的pH增大了3,AD的pH变化小于3,说明A为一水合氨,B为NaOH,C为HCl,D为醋酸,
故答案为:NaOH;HCl;
(2)一水合氨与盐酸反应生成氯化铵和水,反应的离子方程式为NH3•H2O+H+=NH4++H2O,
故答案为:NH3•H2O+H+=NH4++H2O;
(3)等物质的量的NaOH和CH3COOH充分混合后生成CH3COONa溶液,醋酸根离子部分水解,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知c(Na+)>c(CH3COO-),溶液中离子浓度大小为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(4)a.CH3COOH溶液中,根据电荷守恒可知:c(H+)=c(OH-)+c(CH3COO?),故a正确;
b.0.1mol/L 的CH3COOH溶液加水稀释,溶液中氢离子浓度减小,由于水的离子积不变,则溶液中c(OH-)增大,故b错误;
c.CH3COOH溶液中加入少量CH3COONa固体,醋酸根离子浓度增大,则平衡逆向移动,故c正确;
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后,醋酸过量,则混合液呈酸性,溶液的pH<7,故d正确;
故答案为:b.
点评 本题考查酸碱混合溶液定性判断、溶液pH的计算、弱电解质的电离等知识点,侧重考查学生分析判断及计算能力,明确溶液酸碱性与溶液pH的关系为解答关键,知道影响弱电解质的电离平衡的因素,能够根据电荷守恒、物料守恒等知识判断离子浓度大小,题目难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4中含有共价键的数目为4NA | |
| B. | 常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA | |
| C. | 室温时,1L pH=2的NH4Cl溶液中由水电离出的H+为10-12NA | |
| D. | 一定条件下6.4gSO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第0族 | B. | 第四周期第ⅠA族 | C. | 第三周期第ⅠA族 | D. | 第三周期第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎打翻燃着的酒精灯,立即用湿抹布盖灭 | |
| B. | 实验室制取氯气如果有尾气处理装置,可不用在通风橱中进行 | |
| C. | 给盛有液体的试管加热时,要不断移动试管或加入碎瓷片 | |
| D. | 浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 《西游记》中孙悟空一个“筋头云”,十万八千里,其乃“腾云驾雾”而行,其中的云不是胶体,雾是胶体 | |
| B. | 《水浒》中经典片段-----智劫生辰纲中,晁盖等人用蒙汗药药倒杨智等人.其使用的蒙汗药的主要成份可能是NaCN | |
| C. | 《三国演义》中,诸葛亮擒拿南王孟获时路遇哑泉,人饮用了哑泉水后,一个个说不出话来,其主要成份是CuSO4.智者指教,饮安乐泉水可解毒,安乐泉水主要成份可能是氢氧化钙 | |
| D. | 《红楼梦》中有经典语句:女儿是水做的骨肉,男人是泥做的骨肉.水分子间通过氢键结合而质软,泥因其主要成分是碳酸钙而质硬.这句话借此形容男女的性格差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 回收废旧电池 | |
| B. | 加强控制燃放烟花爆竹法规 | |
| C. | 停止使用含铅汽油 | |
| D. | 将工厂烟囱加高,减少周围大气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
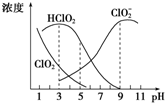 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO${\;}_{2}^{-}$、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO${\;}_{2}^{-}$、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数约为Ka=10-6 | |
| C. | 25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合(忽略Cl-),则混合溶液中有c(HClO2)+2c(H+)═c(ClO${\;}_{2}^{-}$)+2c(OH-) | |
| D. | 使用该漂白剂的最佳pH为3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
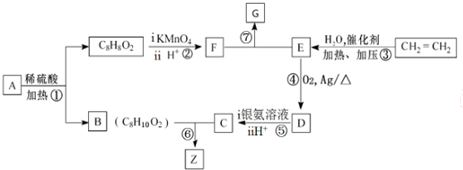
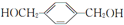 ,其所含官能团名称为羟基.
,其所含官能团名称为羟基. .
.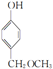 ,
,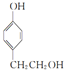 ,
,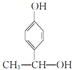 ,
,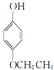 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LC5H12含有的分子数为0.5NA | |
| B. | 21g乙烯与丁烯的混合气体中含有3NA个C-H键 | |
| C. | 1L0.1mol/LNH4NO3溶液中含有0.2NA个N | |
| D. | 光照下,1molCl2与足量CH4完全反应,生成NA个HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com