
| A. | 淀粉碘化钾溶液加酸后变蓝:4I-+O2+4H+═2I2+2H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 在Fe(NO3)2和KI组成的混合溶液中滴入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
分析 A.碘离子具有强的还原性,能够被氧气氧化生成单质碘;
B.依据沉淀转化规则,二者反应生成氢氧化铁沉淀和氯化镁;
C.硝酸根离子氧化性强于三价铁离子,氢离子少量,硝酸根离子先被还原;
D.NH4Fe(SO4)2与Ba(OH)2按照物质的量之比为:1:2反应生成硫酸钡、一水合氨和氢氧化铁.
解答 解:A.淀粉碘化钾溶液加酸后变蓝,离子方程式:4I-+O2+4H+═2I2+2H2O,故A正确;
B.氢氧化铁溶解度小于氢氧化镁所以向FeCl3溶液中加入Mg(OH)2二者反应生成氢氧化铁沉淀和氯化镁,离子方程式:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+,故B正确;
C.在Fe(NO3)2和KI组成的混合溶液中滴入少量稀盐酸,硝酸根离子先被还原,离子方程式:6I-+8H++2NO3-═3I2+2NO↑+4H2O,故C错误;
D.NH4Fe(SO4)2与Ba(OH)2按照物质的量之比为:1:2反应生成硫酸钡、一水合氨和氢氧化铁,离子方程式:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Fe(OH)3↓,故D正确;
故选:C.
点评 本题考查了离子方程式的正误判断,题目难度中等,试题侧重于元素化合物的性质的综合应用,注意物质的化学式、电荷守恒和质量守恒的判断,注意反应物用量对反应的影响,选项CD为易错选项.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
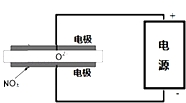 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯(SO2、H2O):碱石灰,洗气 | B. | 乙烷(乙烯):酸性 KMnO4,洗气 | ||
| C. | 炭粉(MnO2):热的浓盐酸,过滤 | D. | Cl2(HCl):饱和食盐水,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、SO2、NH3都是直线形分子 | |
| B. | CO2、NH3、H2S 的键角依次减小 | |
| C. | H2O2、N2H4分子的中心原子都是 sp3杂化 | |
| D. | C、N、F元素的电负性依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应为:Fe-2e-═Fe2+ | B. | 电解过程中pH不变 | ||
| C. | 过程中有Fe(OH)3生成 | D. | 上述反应中Cr2O72-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
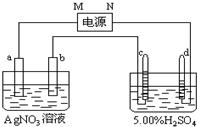
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com