
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极,下列叙述错误的是( )
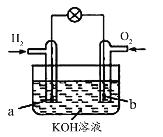
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH――4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.溶液中OH-向正极移动,K+、H+向负极移动
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

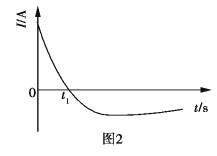
下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是![]() +2H++e=NO2↑+H2O
+2H++e=NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法 命名下列有机物
(1)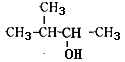 ____________________________________________, 由 该 物 质 制 得 烯 烃 的 反 应 条 件 为_____,
____________________________________________, 由 该 物 质 制 得 烯 烃 的 反 应 条 件 为_____,
(2)![]() _____,由该物质生成顺式聚合物的结构简式是_____。
_____,由该物质生成顺式聚合物的结构简式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢分解制取氢气和硫磺的反应原理为2H2S(g)![]() S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:
S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:
n/mol t/min | n(H2S) | n(S2) | n(H2) |
0 | 2.0 | 0 | 0 |
2 | 1.0 | ||
4 | 0.8 | ||
6 | 0.6 |
下列说法不正确的是( )
A.0~2min 生成H2的平均反应速率为0.25 mol·L-1·min-1
B.上述反应的平衡常数K=0.675
C.3分钟时,H2S的分解率一定小于60%
D.平衡后,向容器中通入少量O2,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)l0Be和9Be___(填序号)。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.互为同位素
(2)写出A1(OH)3与NaOH溶液反应的化学方程式:___。
(3)研究表明28A1可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是__(填序号)。
a.比较Mg(OH)2与A1(OH)3的碱性强弱
b.比较这两种元素的最高正化合价
c.将打磨过表面积相同的镁条和铝片分别和100℃热水作用,并滴入酚酞溶液
d.比较这两种金属的硬度和熔点
(4)目前还有一种测量方法叫“钾氩测年法”。
两种常见简单阴离子的核外电子排布与Ar相同,两者的半径大小关系为:___(用化学符号表示);其中一种离子与钾同周期相邻元素的离子所形成的化合物可用作干燥剂,用电子式表示该物质的形成过程:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组进行测定某变质的铁铝合金(杂质主要为Al2O3和Fe2O3)样品中铁含量,并制备Fe3O4胶体粒子,相关实验方案设计如下:

已知:乙醚[(C2H5)2O]易燃,沸点为34.5度,微溶于水,密度比水小。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
请回答下列问题:
(1)溶液II中主要金属阳离子是__________________。
(2)步骤I中试剂A最佳选择的是_____________。
A.浓硝酸 B.浓硫酸 C.浓盐酸+双氧水 D.稀盐酸+双氧水
(3)步骤II的“一系列操作”包括如下实验步骤,选出其正确操作并按序列出字母:分液漏斗中加水检验是否漏水→向溶液中加入适量浓盐酸和乙醚,转移至分液漏抖→(__________)→(_________)→(__________)→(__________)→f→(_________)→a→(__________)→d→(_________)。
a.左手拇指和食指旋开旋塞放气;
b.用右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转,并用力振摇;
c.静置分层;
d.打开上口玻璃塞,将下层液体从下口放出,上层液体从上口倒出;
e.混合两次分液后的上层液体;
f.向下层液体中加入浓盐酸和乙醚并转移至分液漏斗;
(4)下列关于步骤Ⅲ和步骤VI的涉及的操作说法正确的是_______________。
A.步骤Ⅲ中蒸馏操作时,为加快蒸馏速度,采用酒精灯大火加热,收集34.5℃的馏分
B.为减少乙醚挥发,在蒸馏操作时,收集乙醚的锥形瓶应放置在冰水浴中
C.步骤VI由混合溶液制得Fe3O4胶体粒子的过程中,须持续通入N2,防止Fe2+被氧化
D.析出Fe3O4胶体粒子后通过抽滤,洗涤,干燥获得Fe3O4胶体粒子
(5)步骤IV测定Fe3+方法有多种,如转化为Fe2O3,间接碘量滴定,分光光度法等。
①步骤IV主要作用是测定样品中的铁总含量和______________________。
②步骤IV实验时采用间接碘量法测定Fe3+含量,具体过程如下:向25.00mL溶液中加入过量KI溶液,充分反应后,滴入几滴淀粉作指示剂,用0.1000mol·L-1Na2S2O3标准溶液进行滴定,到达滴定终点时,消耗Na2S2O3标准溶液体积为VmL。已知滴定反应为:I2+2Na2S2O3=2NaI+Na2S4O6。不考虑Fe3+和I-反应限度和滴定操作问题,实际测定的Fe含量往往偏高,其主要原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列有关说法正确的是
A. 向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B. 将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L
C. 因为H2SO4是强酸,所以反应:CuSO4十H2S=CuS↓+H2SO4不能发生
D. 除去工业废水中的Cu2+可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30mL1.0molL-1H3PO4和3mL30%H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30mL1.0molL-1H3PO4和3mLH2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85%H3PO4配制100mL1.0mol·L-1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)请结合实验Ⅱ中现象,分析铁钉与H3PO4反应的产物_______。
(3)探究实验Ⅰ中停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是未排除O2的干扰,请解释O2是如何干扰实验的:_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。形成氧化膜(以Fe3O4计)的离子方程式是____。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析其原因:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com