
| A. | 反应速率降低 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
分析 保持温度不变,将体积压缩为原来的$\frac{1}{2}$,如平衡不移动,A气体的浓度为1mol/L,实际上A的浓度变为0.9mol/L,说明平衡向正方向移动,据此结合选项解答.
解答 解:保持温度不变,将体积压缩为原来的$\frac{1}{2}$,如平衡不移动,A气体的浓度为1mol/L,实际上A的浓度变为0.8mol/L,说明平衡向正方向移动,
A、压强增大反应速率增大,正逆反应速率都增大,故A错误.
B、体积减小即压强增大,平衡向正方向移动,故B正确;
C、平衡向正方向移动,B的转化率增大,故C正确;
D、体积减小,压强增大,平衡向正方向移动,所以正方向是气体系数和减小的方向,a+b>c+d,故D错误;
故选BC.
点评 本题考查学生影响化学平衡移动的因素等方面的知识,注意知识的归纳和梳理是关键,难度中等.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
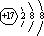 .乙的单质的电子式为
.乙的单质的电子式为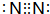 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答:
氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
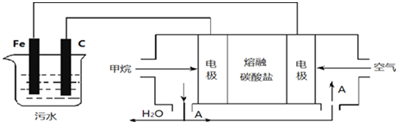
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
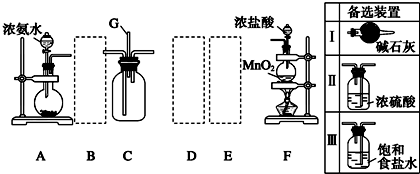
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
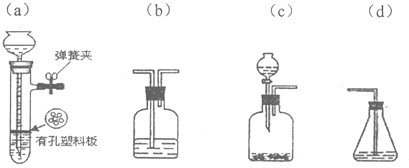
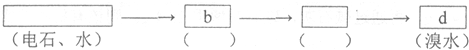
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com