
【题目】目前处理烟气中的SO2有三种方法:液吸法、还原法、电化学法。
I.液吸法
25℃,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5
第1步:用过量浓氨水吸收SO2,并在空气中氧化。
第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-![]() CaSO4↓+2NH3·H2O。
CaSO4↓+2NH3·H2O。
(1)25℃,(NH4)2SO3溶液呈___________(填“酸性”、“碱性”、“中性”)
(2)通过计算第2步反应的K判断第2步反应___________(填“能”或“不能”)进行完全。(一般认为K>105时反应就进行完全了。)
Ⅱ.还原法
已知:①2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1=-37.0kJ·mo1-1
S(l)+2CO2(g) △H1=-37.0kJ·mo1-1
②2H2(g)+SO2(g)![]() S(1)+2H2O(g) △H2=+45.0kJ·mo1-1
S(1)+2H2O(g) △H2=+45.0kJ·mo1-1
③2CO(g)+O2(g)==2CO2(g) △H3=-566.0 kJ·mol-1
④2H2(g)+O2(g)==2H2O(g) △H4=-484.0kJ·mo1-1
(1)写出液态硫(S)燃烧的热化学方程式_________________________________。
(2)一定压强下,反应①SO2的平衡转化率[α(SO2)]与投料比的比值![]() 温度(T)的关系如图所示。
温度(T)的关系如图所示。
则CO的平衡转化率:N___________M(填“>”、“<”、“=”,下同);逆反应速率:N___________P。

Ⅲ.电化学法
(1)原电池法:写出SO2、O2和稀H2SO4所构成的原电池的负极反应式___________。
(2)电解法:先用Na2SO4溶液吸收烟气中的SO2,再用离子膜电解法电解吸收液得到单质硫,同时在阳极得到副产物氧气,装置如下图所示。

①b为电源的___________(填“正极”或“负极”)。
②用Na2SO4溶液代替水吸收烟气中的SO2,目的是______________________。
③若电解一段时间后通过质子交换膜的离子数为1.204×1024个,则通过处理烟气理论上能得到硫___________Kg。
【答案】碱性 能 ![]()
![]() -529.0 kJ·mol-1 > <
-529.0 kJ·mol-1 > < ![]() 正极 增强溶液导电能力,加快电解速率 16
正极 增强溶液导电能力,加快电解速率 16
【解析】
I. (1) 根据Kb(NH3·H2O)=1.8×10-5、H2SO3的Ka2=1.0×10-7分析25℃,(NH4)2SO3溶液的酸碱性;(2)![]() ;Ⅱ. (1)根据盖斯定律计算液态硫(S)燃烧的焓变;(2)相同温度下,
;Ⅱ. (1)根据盖斯定律计算液态硫(S)燃烧的焓变;(2)相同温度下,![]() 越大,α(SO2)越大,根据图示可知
越大,α(SO2)越大,根据图示可知![]() ;温度越高反应速率越快;Ⅲ. (1) SO2中的S是+4价,反应时升高到+6价,所以发生氧化反应,是原电池的负极;(2)①用离子膜电解法电解吸收液得到单质硫,硫元素化合价降低发生还原反应,在电解池的阴极,同时溶液中氢氧根离子在阳极失电子生成氧气,由于铜是活泼电极,所以铜电极做阴极,铂棒做阳极,电源正极连接阳极,电源负极接阴极;②从溶液导电能力和电解原理分析;③阴极是二氧化硫在酸性溶液中得到电子生成单质硫,通过质子交换膜的离子数与转移电子数相等。
;温度越高反应速率越快;Ⅲ. (1) SO2中的S是+4价,反应时升高到+6价,所以发生氧化反应,是原电池的负极;(2)①用离子膜电解法电解吸收液得到单质硫,硫元素化合价降低发生还原反应,在电解池的阴极,同时溶液中氢氧根离子在阳极失电子生成氧气,由于铜是活泼电极,所以铜电极做阴极,铂棒做阳极,电源正极连接阳极,电源负极接阴极;②从溶液导电能力和电解原理分析;③阴极是二氧化硫在酸性溶液中得到电子生成单质硫,通过质子交换膜的离子数与转移电子数相等。
I. (1) Kb(NH3·H2O)=1.8×10-5大于H2SO3的Ka2=1.0×10-7,所以NH4+的水解程度小于SO32-,所以25℃,(NH4)2SO3溶液的显碱性;(2)
所以第2步反应能完全进行。
Ⅱ. (1)②2H2(g)+SO2(g)![]() S(1)+2H2O(g) △H2=+45.0kJ·mo1-1
S(1)+2H2O(g) △H2=+45.0kJ·mo1-1
④2H2(g)+O2(g)==2H2O(g) △H4=-484.0kJ·mo1-1
根据盖斯定律,④-②得液态硫(S)燃烧的热化学方程式![]()
![]() -529.0 kJ·mol-1;(2)相同温度下,
-529.0 kJ·mol-1;(2)相同温度下,![]() 越大,α(SO2)越大,根据图示可知
越大,α(SO2)越大,根据图示可知![]() ,M、N点α(SO2)相等,M点CO的投放大于N,所以CO的平衡转化率:N>M;温度越高反应速率越快,P点的温度大于N,所以逆反应速率:N<P。;Ⅲ. (1) SO2、O2和稀H2SO4所构成的原电池,SO2在负极失电子生成SO42-,负极反应式是
,M、N点α(SO2)相等,M点CO的投放大于N,所以CO的平衡转化率:N>M;温度越高反应速率越快,P点的温度大于N,所以逆反应速率:N<P。;Ⅲ. (1) SO2、O2和稀H2SO4所构成的原电池,SO2在负极失电子生成SO42-,负极反应式是![]() ;(2)①用离子膜电解法电解吸收液得到单质硫,硫元素化合价降低发生还原反应,该反应在电解池的阴极发生,同时溶液中氢氧根离子在阳极失电子生成氧气,由于铜是活泼电极,所以铜电极做阴极,铂棒做阳极,电源正极连接阳极,电源负极连接阴极,故b是电源正极;②Na2SO4溶液代替水吸收烟气中的SO2,电解过程中可以增强溶液导电能力,加快电解速率;③阴极是二氧化硫在酸性溶液中得到电子生成单质硫,电极反应为:SO2+4H++4e-═S+2H2O;通过质子交换膜的离子数为1.204×1024个,其物质的量为
;(2)①用离子膜电解法电解吸收液得到单质硫,硫元素化合价降低发生还原反应,该反应在电解池的阴极发生,同时溶液中氢氧根离子在阳极失电子生成氧气,由于铜是活泼电极,所以铜电极做阴极,铂棒做阳极,电源正极连接阳极,电源负极连接阴极,故b是电源正极;②Na2SO4溶液代替水吸收烟气中的SO2,电解过程中可以增强溶液导电能力,加快电解速率;③阴极是二氧化硫在酸性溶液中得到电子生成单质硫,电极反应为:SO2+4H++4e-═S+2H2O;通过质子交换膜的离子数为1.204×1024个,其物质的量为![]() 2mol,依据电极反应中定量关系计算,每通过4mol氢离子,生成硫单质1mol,则通过2mol氢离子可生成硫单质0.5mol,质量为0.5mol×32g/mol=16g。
2mol,依据电极反应中定量关系计算,每通过4mol氢离子,生成硫单质1mol,则通过2mol氢离子可生成硫单质0.5mol,质量为0.5mol×32g/mol=16g。


科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,氧杂螺戊烷的结构简式为![]() ,则下列说法正确的是
,则下列说法正确的是
A. lmol该有机物完全燃烧需要消耗5.5molO2
B. 二氯代物超过3种
C. 该有机物与环氧乙烷互为同系物
D. 该有机物所有碳、氧原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )

A. 由图分析N电极为电池的正极
B. 阴极的电极反应为CO2+H2O+2e-=CO+2OH-
C. OH-通过离子交换膜迁向左室
D. 反应完毕,该装置中电解质溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置进行中和热测定实验,请回答下列问题:

(1)仪器A的名称为_______。
(2)大小烧杯之间填满碎泡沫塑料的作用是__________。
(3)实验中若用0.50mol·L-1H2SO4溶液跟0.50mol·L-1NaOH溶液进行中和热测定,写出表示该反应中和热的热化学方程试(中和热为57.3kJ·mol-1):__________________。
(4)取30mL0.50mol·L-1 H2SO4溶液与50mL0.50mol·L-1 NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高4.1℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H=_____,
(5)上述实验数值结果与57.3 kJ/mol有偏差,产生此偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
(6)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”.“不相等”),所求中和热___(填“相等”.“不相等”),若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会____(填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是
A. 两种气体A与B的相对分子质量之比为m∶n
B. 同质量气体A与B的分子数之比为n∶m
C. 同温同压下,A、B两气体的密度之比为n∶m
D. 相同状况下,同体积A、B两气体的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列说法一定正确的是( )

A.一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42-、Fe3+
B.一定存在H+、Al3+、NH4+、SO42-,可能存在Na+、Mg2+
C.溶液中c(H+):c(Al3+):c(Mg2+)=1:1:2
D.溶液中c(H+)/c(SO42-)![]() 2/9
2/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制100mL 0.10molL﹣1的CuSO4溶液。以下操作1~5是其配制的过程及示意图:
操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解;
操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中;
操作3:继续向X中加蒸馏水至液面离X的刻度线l~2cm处;
操作4、操作5:见图
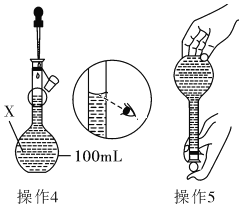
(1)仪器X的名称是______________;
(2)操作1中,应称取胆矾晶体的质量为_____________;
(3)若其余操作步骤均正确,根据操作4所配的溶液浓度__(选填“偏大”、“偏小”、“无影响”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应2H2O2![]() 2H2O+O2↑可制备氧气。
2H2O+O2↑可制备氧气。
① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的___(填“深”或“浅”),其原因是_______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com