
【题目】A、B、C是三种短周期主族元素。甲是一种常见的温室气体,A、B、C原子序数之和为26,它们之间存在如图所示关系。下列说法正确的是

A. 简单气态氢化物的稳定性:C > B
B. 原子半径大小: C > B > A
C. 与甲含相同元素的另一化合物只含非极性键
D. 工业上常用电解熔融乙物质来制取A的单质
【答案】A
【解析】
甲是一种常见的温室气体,高中阶段常见的温室气体包括二氧化碳(CO2)、氧化亚氮(N2O)、甲烷等,但是有B和C两种单质可以生成甲,那么甲为二氧化碳,A、B、C原子序数之和为26,包括了C和O两种元素,另一种元素为12号元素,为Mg。可以知道Mg和CO2的反应2Mg+CO2=2MgO+C,乙为MgO。A为Mg,B为C,C为O。
A.简单的氢化物,C的非金属性比O弱,则CH4的稳定性比H2O弱;A项正确;
B.原子半径,同周期原子序数越大半径越小,Mg的原子半径比Be大,Be的半径比C大,所以排序为A(Mg)> B(C)> C(O),B项错误;
C. 与甲含相同元素的另一化合物为CO,只含极性键,C项错误;
D. 乙为MgO,熔点高,电解MgO效能大,工业是通过电解熔融的MgCl2,D项错误;
本题答案选A。


科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)可抑制金属腐蚀。以钼精矿(主要成分为MoS2,含少量杂质)为原料,制备钼酸钠晶体的主要流程图如下。

回答下列问题
(1)完成下列反应:_____MoS2+ _____O2![]() _____SO2+ _____MoO3
_____SO2+ _____MoO3
在焙烧炉中,空气从炉底进入矿石经粉碎后从炉顶进入,这样处理的目的是__________________。
(2)浓氨水浸取粗产品获得(NH4)2MoO4溶液,其化学反应方程式为____________________________;该反应说明MoO3______(填“有”或“没有”)酸性氧化物的性质。
(3)常温下,沉钼阶段所得废液为(NH4)2SO4稀溶液。若(NH4)2SO4稀溶液的pH=a,则![]() =_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,
=_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,![]() 将_________(填“变大”“不变”或“变小”)。
将_________(填“变大”“不变”或“变小”)。
(4)已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,获得Na2MoO4·2H2O的操作为_____________。
温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 |
析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | ||||||
溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45. |
结晶得到的母液可以在下次结晶时重复使用,但达到一定次数后必须净化处理,原因是_____________。
(5)空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜,在密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入的物质是___________(填选项字母)。
A. NaNO2 B.通入适量N2 C.油脂 D.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一密闭容器中盛有aLCl2和H2的混合气体,用电火花引燃后,恢复到原来状态,发现气体仍为aL.用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余。由以上条件,推知原混合气体中Cl2和H2物质的量之比一定是_____。
A.Cl2:H2=1 B.Cl2:H2<1 C.Cl2:H2≥1 D.Cl2:H2≤1
(2)氢气在氯气中充分燃烧,若两者的体积比为1:2,所得混合物用200mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收。
①求原NaOH溶液的质量分数_______________。(结果用小数表示,保留3位小数)
②求所得溶液中Cl﹣与ClO﹣的物质的量之和__________________。
③求溶液中ClO﹣的物质的量_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积不变的密闭容器中,发生可逆反应 N2(g)+3H2(g) ![]() 2NH3(g),下列说法中正确的是
2NH3(g),下列说法中正确的是
A. 若向密闭容器中再充入N2,则反应速率减慢
B. 若反应前10s时,H2减少了0.3mol,则v(H2)=0.03mol·L-1·s-1
C. 若某时刻N2、H2、NH3的浓度不再发生变化,则表明该反应达到了平衡状态
D. 若某时刻消耗了1 molN2同时生成了2 molNH3,则表明该反应达到了平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)顺铂(化学名称为顺二氯二氨合铂(II),化学式为PtCl2(NH3)2,相对分子质量为:300)是一种用于治疗癌症的药物,一片顺铂药片所含顺铂的质量为6×10-4g。那么一片顺铂药片中N原子的物质的量________;
(2)乙烯气体(C2H4)是石油化工产品之一,也是最重要的有机化工基础原料之一,在标准状况下其密度为_______g.L-1;(已知:标准状况下,Vm=22.4Lmol-1 )
(3)现有一种矿泉水样品,1.0升的该矿泉水含有4.8×10-2gMg2+。则________升矿泉水中含有1molMg2+;
(4)某“84消毒液”1000mL.其有效成分为NaClO(式量:74.5),质量分数为14.9%,密度为1.2g/L。其溶质的物质的量浓度为________;
(5)已知CO和CO2的混合气体7.2g。在标准状况下所占的体积为4.48L。则该混合气体中氧元素的质量为_______;
(6)如图所示两瓶体积相等的气体,在同温同压下,若瓶1两种气体______(填“物质的量”或者“质量”)相等,则两瓶中的气体原子总数和质量均相等。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型非金属材料,室温下能缓慢水解。可由铝粉在氮气氛围中1700℃合成,产物为白色到灰蓝色粉末。某小组探究在实验室制备AlN并测定产品纯度,设计实验如下。请回答:
(一)制备AlN

(1)按气流由左向右的方向,上述装置的正确连接顺序为j→__________________→i(填仪器接口字母编号)。
(2)实验时,以空气为原料制备AlN。装置A中还原铁粉的作用为________________,装置B中试剂X为_____________________。
(二)测定产品纯度
取m g的产品,用以下装置测定产品中AlN的纯度(夹持装置已略去)。
已知:AlN + NaOH + H2O = NaAlO2 + NH3↑
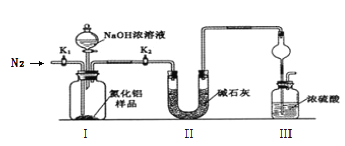
(3)完成以下实验步骤:组装好实验装置,首先_________________________________,加入实验药品。接下来的实验操作是关闭______________________________并打开______________,再打开分液漏斗活塞加入足量NaOH浓溶液后关闭,至不再产生气体。再______________,通入氮气一段时间,测定装置III反应前后的质量变化为n g。
(4)实验结束后,计算产品中AlN的纯度为___________﹪(用含m、n的代数式表示)。
(5)上述实验的设计仍然存在缺陷,你认为可能的缺陷及会导致的测定结果____________(用 “偏高”、“偏低”描述)如何______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)反应②:H2(g)+CuO(s) Cu(s)+H2O(g),二者在温度T下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
A. 反应①的平衡常数K1=c(CO2).c(Cu)/[c(CO).c(CuO)]
B. 反应③的平衡常数K=K1K2。
C. 对于反应③,恒容时,温度升高,K值减小,则正反应△H<0
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量; ②增加CO的量;
③将容器的体积缩小一半; ④保持体积不变,充入N2以增大压强;
⑤升高反应体系的温度; ⑥保持压强不变,充入N2以增大体积。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com