Ⅰ.如何降低大气中CO
2的含量及有效利用CO
2,目前已引起各国普遍重视.
(1)工业上有一种方法是用CO
2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO
2和3mol H
2,在500℃下发生反应:CO
2(g)+3H
2(g) CH
3OH(g)+H
2O(g).实验测得CO
2(g)和CH
3OH(g)的浓度随时间变化如图1所示.
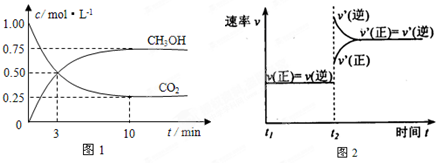
①从反应开始到平衡,氢气的平均反应速率v(H
2)=
0.225mol/(L?min)
0.225mol/(L?min)
;
②图2是改变温度时H
2的化学反应速率随时间变化的示意图,则该反应的正反应是
放
放
热(填“吸”或“放”)反应.
③该反应的平衡常数K为
5.33
5.33
(保留两位小数).若提高温度到800℃进行,达平衡时,K值
减小
减小
(填“增大”、“减小”或“不变”),
④500℃达平衡时,CH
3OH的体积分数ω为
0.3
0.3
.
(2)在载人航天器的生态系统中,不仅要求分离去除CO
2,还要求提供充足的O
2.某种电化学装置可实现如下转化:2CO
2=2CO+O
2,CO可用作燃料.已知该反应的阳极反应为:4OH
--4e
-=O
2↑+2H
2O,则阴极反应式为
2CO2+4e-+2H2O=2CO+4OH-
2CO2+4e-+2H2O=2CO+4OH-
.
Ⅱ.工业上可利用煤的气化产物(CO和H
2)合成二甲醚(CH
3OCH
3),其三步反应如下:
①2H
2 (g)+CO(g)?CH
3OH (g)△H=-90.8kJ?mol
-1②2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)△H=-23.5kJ?mol
-1③CO(g)+H
2O(g)?CO
2 (g)+H
2(g)△H=-41.3kJ?mol
-1(3)总合成反应的热化学方程式为
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol
.
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是
CE
CE
(填字母代号).
A.高温高压 B.加入催化剂 C.减少CO
2的浓度 D.增加CO的浓度 E.分离出二甲醚
(5)已知反应②2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)在某温度下的平衡常数K=400.此温度下,在密闭容器中加入CH
3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c/mol?L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正)
>
>
v (逆) (填“>”、“<”或“=”).

 4NO(g)+6H2O(g)+3623KJ;下列叙述正确的是( )
4NO(g)+6H2O(g)+3623KJ;下列叙述正确的是( )

 巧学巧练系列答案
巧学巧练系列答案