
X2����������в���ȱ�ٵ����壬Y�ǵؿ��к������Ľ���Ԫ�أ�ZԪ�ص���ɫΪ��ɫ��W2��һ�ֻ���ɫ���塣��ش��������⣺
��1��д��Z��Ԫ�ط��� ������X��ԭ�ӽṹʾ��ͼ ��
��2����ҵ������W2����ʯ����ȡƯ�ۣ���Ư�۵���Ч�ɷ��� ��
��3��ZԪ����ɵ�������A��B��һ�������¿����ת����A��B�������������ᷴӦ�Ҳ�����ȫһ��������A�Ƿ��ͷ۵���Ҫ�ɷ�֮һ����Bͨ�����Ϸ�Ӧת��ΪA�Ļ�ѧ����ʽ ��
��4����ҵ����ͨ�����Y2X3ұ��Y���ʣ���������0.1 mol Y���ʣ���ת�� mol���ӣ�
��5������MgSO4��Y2(SO4)3�Ļ����Һ����֪c��SO42���� = 1.5mol��L��1������Һ��c��Y3+��= mol��L��1�����У���һ������û����Һ�м���Z���ʵ����ʵ��������ɳ��������ʵ����Ĺ�ϵ��ͼ��
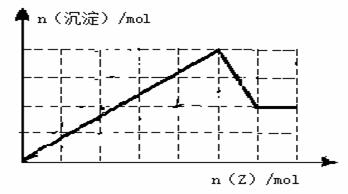
 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵������ȷ����(����)
A�����и��ϲ��϶��ɻ������ǿ�����������
B�����ϲ��ϵĻ�ѧ�ɷֿ���ֻ��һ��Ҳ���ܺ��ж���
C�������ڸ��ϲ�������Ǽ�����
D�������ϲ��ϰ�������࣬�ɷ�Ϊ��֬�����ϲ��ϡ����������ϲ��Ϻ���ά��ǿ���ϲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�״�����Ϊȼ�ϵ�ص�ԭ�ϡ���CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ��Ӧ���Ʊ��״���
I��CH4 ( g ) + H2O ( g ) ��CO ( g ) + 3H2 (g ) ��H ��+206.0 kJ��mol��1
II��CO ( g ) + 2H2 ( g ) �� CH3OH ( g ) ��H ����129.0 kJ��mol��1
��1��CH4(g)��H2O(g)��Ӧ����CH3OH (g)��H2(g)���Ȼ�ѧ����ʽΪ ��
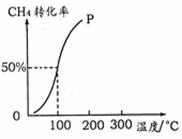 ��2����1.0 mol CH4��2.0 mol H2O ( g )ͨ���ݻ�Ϊ100 L�ķ�Ӧ�ң���һ�������·�����ӦI�������һ����ѹǿ��CH4��ת�������¶ȵ�
��2����1.0 mol CH4��2.0 mol H2O ( g )ͨ���ݻ�Ϊ100 L�ķ�Ӧ�ң���һ�������·�����ӦI�������һ����ѹǿ��CH4��ת�������¶ȵ�
��ϵ����ͼ��
�ټ���100 ��ʱ�ﵽƽ�������ʱ��Ϊ5 min��
����H2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ ��
��100��ʱ��ӦI��ƽ�ⳣ��Ϊ ��
��3����ѹǿΪ0.1 MPa���¶�Ϊ300�������£���a mol CO��
3a mol H2�Ļ�������ڴ��������·�����ӦII���ɼ״���ƽ����������ݻ�ѹ����ԭ����l/2�������������䣬��ƽ����ϵ������Ӱ���� �� (����ĸ���)��
A��c ( H2 )���� B������Ӧ���ʼӿ죬�淴Ӧ���ʼ��� C��CH3OH �����ʵ������� D������ƽ��c ( H2 )/ c (CH3OH )��С E��ƽ�ⳣ��K����
��4��д���״���������KOH��Һ��ȼ�ϵ�ظ����ĵ缫��Ӧʽ�� ��
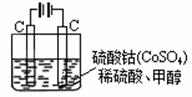 ��5���״���ˮ�ʻ����һ������Ⱦ����һ�ֵ绯ѧ��������
��5���״���ˮ�ʻ����һ������Ⱦ����һ�ֵ绯ѧ��������
������Ⱦ����ԭ���ǣ�ͨ���Co2+������Co3+��
Ȼ����Co3+����������ˮ�еļ״�������CO2��������
ʵ��������ͼװ��ģ���������̣�
�� д�������缫��Ӧʽ ��
�� д����ȥ�״������ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ͬ�ļס�������ֲ��Ӫ��Һ����������ֵ����ʵ���Ũ�����±���
| KCl | K2SO4 | ZnCl2 | ZnSO4 | |
| �� | 0.3 mol��L-1 | 0.2 mol��L-1 | 0 | 0.1 mol��L-1 |
| �� | 0.1 mol��L-1 | 0.3 mol��L-1 | 0.1 mol��L-1 | 0 |
���ж�����Ӫ��Һ�ɷֵķ����У���ȷ����( )
A��������Һ��n��Zn2+����ͬ B��������Һ��c��Cl-��֮��Ϊ3:1
C������Һ��c��K+��=0.5 mol��L-1 D��������Һ������N��SO42-�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA���������ӵ�����������˵����ȷ����( )
A�����³�ѹ�£�2����������ԭ����ĿΪNA
B��4.6������ˮ��Ӧʱʧȥ�ĵ�����ĿΪ0.2NA
C���ڱ�״���£�22.4LNH3������������ĿΪNA
D��1 L0.5mol•L-1Na2SO4��Һ�������е�Na+������ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ܹ���������BaCl2�� NaCl �� Na2CO3�������ʵ��Լ���
A.AgNO3��Һ B.ϡ���� C.ϡ���� D.ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ѧ�ҽ�����Ԫ��Ǧ��봵�ԭ�Ӻ˶�ײ�������һ��������118��������Ϊ175�ij���Ԫ�أ���Ԫ��ԭ�Ӻ�������������������֮����(����)
A��57���������������������� B��47
C��61 D��293
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����
A���ϳ���ά���ά�����������ǽ�������
B��4.0g NaOH����������������Ϊ0.1NA��NA��ʾ�����ӵ�������ֵ��
C������ռƯ�۶���������
D��Cl2ʹʪ�ĺ�ɫ������ɫ����ΪHClO��Ư����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com