
| A. | 放热的反应发生时不必加热 | |
| B. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应在常温下一定很容易发生 |
分析 A.反应热与反应条件无关;
B.化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化;
C.一个化学反应发生的条件与反应的热效应无关;
D.一个化学反应发生的条件与反应的热效应无关.
解答 解:A.燃烧都是放热反应,但需要加热到着火点,故A错误;
B.放热反应是指:反应物所具有的总能量高于生成的总能量,在反应中会有一部分能量转变为热能的形式释放,反之,就是吸热反应,故B正确;
C.需要加热才能发生的反应不一定是吸热反应,如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点,故C错误;
D.放热的反应在常温下不一定很容易发生.如:铝热反应2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe是放热反应,但需在高热条件下以保证足够的热量引发氧化铁和铝粉反应,故D错误;
故选B.
点评 本题考查化学反应的条件与化学反应的热效应间的关系,难度不大,需正确理解放热吸热的本质是解题的关键.


科目:高中化学 来源: 题型:实验题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 65 | 249 | 199.6 |
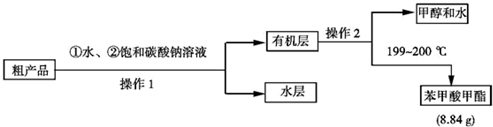
| 检验项目 | 实验现象及结论 |
| 检验粗产品中含有水的操作是 | |
| 检验粗产品中含有硫酸的操作是 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ Cl- K+ SO42- | B. | Na+ NO3 - OH - CO3 2- | ||
| C. | Ba2+ Cl- NO3 - SO4 2- | D. | K+ Na+ Cl- SO4 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y |
| Z |
| A. | 气态氢化物的沸点:X<Y<Z | |
| B. | 最高正化合价:Y>X | |
| C. | X、Y、Z的最高价氧化物对应水化物中,Z的酸性最强 | |
| D. | 若X、Y、Z的原子序数之和等于25,则它们都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | |
| B. | 该样品中Cu、O元素的质量比为10:l | |
| C. | V=448 | |
| D. | 溶解样品时消耗H2SO4的物质的量为0.04 mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂 | B. | 矿物质 | C. | 蛋白质 | D. | 维生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下.22.4L水含有NA个水分子 | |
| B. | 1mol/LNa2C03溶液中含有Na+数目为2NA | |
| C. | 常温常压下,22.4L02中含有2NA个氧原子 | |
| D. | 169O2和O3的混合气体中含氧原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸存放在带橡胶塞的棕色玻璃瓶中 | |
| B. | 四氯化碳萃取溴水中的溴时,水从分液漏斗下口流出 | |
| C. | 红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟 | |
| D. | 某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com