
| 1.40g |
| ag/mol |
| 1.40(17+a) |
| a |
| 1.40g |
| (2a+16)g/mol |
| 1.40(a+17) |
| a+8 |
| 1.40(a+17) |
| a+8 |
| 1.40(17+a) |
| a |
|
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |

查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 |
(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
2 1 |
13 6 |
14 6 |
14 7 |
56 26 |
56 26 |
16 8 |
16 8 |
1 1 |
2 1 |
3 1 |
A Z |
n b |
查看答案和解析>>
科目:高中化学 来源: 题型:
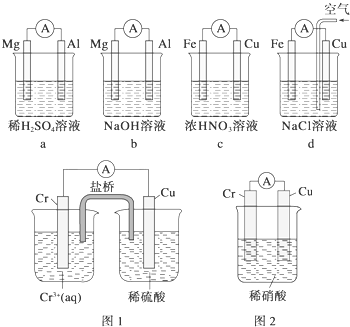 (1)分析如图所示的四个装置,回答下列问题:
(1)分析如图所示的四个装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
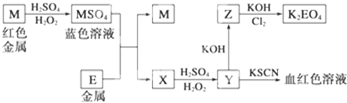
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
| A、上述反应是熵增反应 |
| B、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol?L-1,则此时v(正)<v(逆) |
| C、25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 |
| D、恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO的百分含量将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com