
【题目】为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
A.①②③ B.②③④ C.①③④ D.①②③④
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________,K值大小与温度的关系是:温度升高,K值_______。(填增大、减小、不变、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)= mol·L-1·min-1。
CO2(g) + H2(g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)= mol·L-1·min-1。

(3 )t℃(高于850℃ ),在相同容器中发生上述反应,容器内各物质变化如下表。

①表中3 min~4 min之间反应________(达到平衡,正向进行,逆向进行);C1数值________0.08 mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min问,平衡向逆方向移动,可能的原因是________(单选),表中5 min~6 min之间数值发生变化,可能的原因是________(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在与Al反应能放出H2的无色溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2- ②K+、Fe2+、I-、SO42-③Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-
A.①③B.③⑤C.③④D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:C(s)+1/2O2(g)=CO(g) ΔH=-Q1kJ/mol;CO(g)+1/2O2(g)=CO2(g) ΔH=-Q2kJ/mol。与这些焦炭完全燃烧相比较,损失的热量是( )
A. 1/3Q1kJ B. 1/3Q2kJ C. 1/3(Q1+Q2)kJ D. 1/2Q2kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和氮氧化物的转化和综合利用既有利于节约资源,又有利于保护环境。
⑴H2还原法是处理燃煤烟气中SO2的方法之一。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)= H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)= H2O(g) ΔH=c kJ·mol—1
写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_____________。
⑵20世纪80年代Townley首次提出利用电化学膜脱除烟气中SO2的技术:将烟气预氧化使SO2转化为SO3,再将预氧化后的烟气利用如图所示原理净化利用。
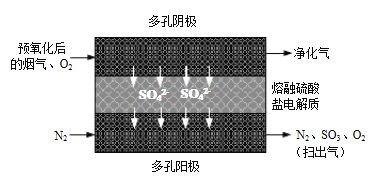
①阴极反应方程式为_____________。
②若电解过程中转移1mol电子,所得“扫出气”用水吸收最多可制得质量分数70%的硫酸_____________g。
⑶利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图Ⅰ、Ⅱ所示。
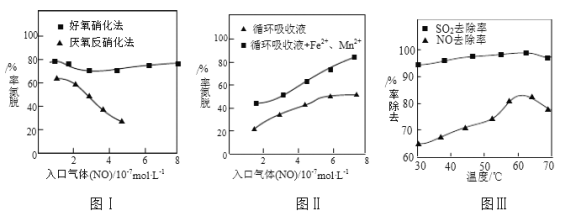
①由图I知,当废气中的NO含量增加时,宜选用____________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为_____________。
⑷研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①温度高于60℃后,NO去除率随温度升高而下降的原因为_____________。
②写出废气中的SO2与NaClO2反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所采取的方法正确的是
A. 除去苯中的苯酚,加入溴水后过滤 B. 除去硝基苯中的NO2,加入NaOH溶液后分液
C. 分离苯和溴苯,加水后分液 D. 可用分液漏斗将甘油和水的混合液体分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是_________,除⑩外原子半径最大的是________。
(2)①③⑤三种元素最高价氧化物对应的水化物碱性最强的是__________ ;⑧⑨形成氢化物的稳定性由强到弱顺序为_________________。
(3)①②③⑤⑧五种元素形成的离子半径由大到小的顺序为______________________
(4)元素⑥的名称是____;元素④的原子结构示意图是/span>_______;元素⑦的氢化物和元素①单质反应的化学方程式为________________。
(5)①⑨形成的化合物灼烧时火焰焰色为________;该化合物的溶液与元素⑧的单质反应的化学方程式为_______________________。
(6)①、⑤和⑧最高价氧化物对应的水化物之间两两相互反应的离子方程式为____________________。
(7)元素③的单质在元素⑥⑦形成的某化合物中燃烧的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确是( )
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥平衡常数一定增大
A.①② B.③⑤ C.②⑤ D.④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com