
【题目】元素周期表是一座开放的“元素大厦”,“元素大厦”尚未“客满”。请你在“元素大厦”中为由俄罗斯科学家利用回旋加速器成功合成的119号超重元素安排好它的房间( )
A. 第八周期第ⅠA族
B. 第七周期第ⅦA族
C. 第七周期0族
D. 第六周期第ⅡA族
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物与生产生活关系密切。请完成下列填空:
(1)肼由N、H 两种元素组成,它常用作火箭推进剂。肼的相对分子质量为32,分子中N、H原子的个数比为1∶2,肼的分子式为_____________。16g 肼分子中所含的氮原子数与标准状况下_______L N2中所含的氮原子数相等。
(2)实验室常用下图所示装置制取并收集氨气。

①实验室制取氨气反应的化学方程式为____________________________________;
②图中方框内收集氨气的装置可选用_________________(填字母序号);
③尾气处理装置中使用倒扣漏斗的作用是_________________________________。
(3)在盛有一定量浓硝酸的试管中加入6.4g的铜片发生反应。请回答下列问题:
①开始阶段,反应的化学方程式为____________________________________,若该反应共产生标准状况下气体2.24L,则反应过程中被还原的HNO3的物质的量为_______。
②反应结束后铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验过程中,我们往往需要记录一些实验的数据,下列数据可信的是:
A. 某常见气体的密度为2.8 g·cm-3
B. 用托盘天平称出固体的质量为7.85 g
C. 某正常雨水的pH为5.6
D. Ba(OH)2·8H2O晶体与NH4Cl晶体混合搅拌后,测得温度升高5℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应类型:①酯化、②取代、③消去、④加成、⑤水解、⑥还原,可能在有机物分子中引入羟基的是( )
A.①②③⑥
B.②④⑤⑥
C.②④⑥
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( ) 
A.图中能量化方式只有一种
B.阳极的电极反应式为2CO32﹣﹣4e﹣=2CO2↑+O2↑
C.若反应中转移1mole﹣ , 则理论上消耗CO32﹣0.5mol
D.当生成12g碳材料时,可收集到22.4L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 苯能使溴水因发生取代反应而褪色,且生成溴苯
B. 甲苯能使酸性高锰酸钾溶液褪色
C. 苯中没有典型的碳碳双键,但能发生加成反应
D. 苯中各原子均在同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工后的废切削液中含有2%~5%的NaNO2,它是一种环境污染物。人们用 NH4Cl溶液来处理此废切削液,使亚硝酸钠转化为无毒物质.该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2;
第二步:NH4NO2![]() N2↑+2H2O
N2↑+2H2O
下列对第二步反应的叙述中正确的是
①NH4NO2仅是氧化剂 ②NH4NO2仅是还原剂
③NH4NO2发生了分解反应 ④只有氮元素的化合价发生了变化
⑤NH4NO2 既是氧化剂又是还原剂
A. ①④⑤ B. ②③④ C. ③④⑤ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、硫的单质及其化合物在生产、生活中应用广泛,辉铜矿(主要成分是Cu2S)是冶炼铜和制硫酸的重要原料.
(1)已知:①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=﹣768.2kJmol﹣1 ②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJmol﹣1
则Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H= .
(2)已知25℃时,KSP(BaSO4)=1.1×1010 , 向仅含0.1molL﹣1 Ba(OH)2的废液中加入等体积0.12molL﹣1硫酸,充分搅拌后过滤,滤液中c(Ba2+)=
(3)上述冶炼过程中会产生大量的SO2 , 回收处理SO2 , 不仅能防止环境污染,而且能变害为宝,回收处理的方法之一是先将SO2转化为SO3 , 然后再转化为H2SO4 . ①450℃时,某恒容密闭容器中存在反应:2SO2(g)+O2(g)2SO3(g)△H<0,下列事实能表明该反应达到平衡的是 .
A.容器内气体密度不变
B.O2、SO2的消耗速率之比为1:2
C.n(SO2):n(O2):n(SO3)=2:1:2
D.容器内压强不再发生变化
②450℃、0.1MPa下,将2.0molSO2和1.0molO2置于5L密闭容器中开始反应,保持温度和容器体积不变,SO2的转化率(α)随着时间(t)的变化如图1所示,则该温度下反应的平衡常数K= . 若维持其他条件不变,使反应开始时的温度升高到500℃,请在图1中画出反应开始到平衡时SO2转化率的变化图象.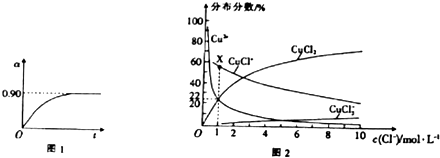
(4)已知CuCl2溶液中,铜元素的存在形式与c(Cl﹣)的相对大小有关,具体情况如图2所示(分布分数是指平衡体系中含铜微粒物质的量占铜元素总物质的量的百分比) ①若溶液中含铜微粒的总浓度为amolL﹣1 , 则X点对应的c(CuCl+)=(用含a的代数式表示).
②向c(Cl﹣)=1molL﹣1的氯化铜溶液中滴入少量AgNO3溶液,则浓度最大的含铜微粒发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuSO4 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com