
【题目】在不同温度下,将2mol X、2mol Y分别充入到不同体积的容器中,发生反应:X(g)+Y (g)![]() mZ(g) ΔH,所得Z的平衡浓度如表所示,下列说法正确的是( )
mZ(g) ΔH,所得Z的平衡浓度如表所示,下列说法正确的是( )
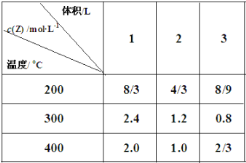
A.m=2 ,ΔH>0
B.300℃时,该反应平衡常数 K=9
C.在3L容器中进行反应,达到平衡的时间:400℃>200℃
D.200℃,2L容器中反应达平衡后,再充入2 mol Z,平衡时 Z 的体积分数增大
【答案】B
【解析】
试题分析:A.依据表中数据分析可知,当温度一定时,压强改变,平衡不移动,说明m=2 ;当压强一定时,随着温度升高,c(Z)减小,说明平衡向逆反应方向移动,则正反应为放热反应,ΔH<0,故A错误;B.300℃时,当体积为1L时,△c(C)=2.4mol/L,则△c(A)=△c(B)=1.2mol/L,则平衡时c(A)=c(B)=(2.0-1.2)mol/L=0.8mol/L,该反应平衡常数 K=c2(C)/[c(A)c(B)]=(2.4×2.4)/(0.8×0.8)=9,故B正确;C.温度越高,化学反应速率越快,达到平衡状态所用时间越短,所以在3L容器中进行反应,达到平衡的时间:400℃<200℃,故C错误;D.根据上述分析可知,该反应前后气体分子数不变,所以200℃,2L容器中反应达平衡后,再充入2molZ,平衡时 Z 的体积分数不变,故D错误。故选B。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),结构如图
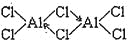
缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。
(3)B原子的电子有 个不同的能级;晶体硼熔点为2300℃,则其为 晶体。
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。
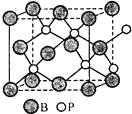
①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼 三溴化磷
②在BP晶胞中B的堆积方式为 。
③计算当晶胞晶格参数为a pm(即图中立方体的每条边长为 a pm)时,磷化硼中硼原子和磷原子之间的最近距离 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液,
(1)混合溶液中共有 种(填数字)不同的粒子。
(2)这些粒子中,浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(3)物质的量之和为0.01mol的两种粒子是__________________。
(4) 和 两种粒子数量之和比OH-多0.008mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
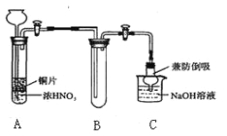
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是 。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的小木条迅速伸进试管内,发现木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的。为准确达到实验目的,需在A、B之间增加一个装置,该装置的作用是 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:①2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2SO4+2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①B中观察到的主要现象是 ,F装置的作用是 。
②在反应前,打开弹簧夹,通入一段时间N2,目的是 。
③充分反应后,检验D装置中反应产物的实验方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如下:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL-1 H2C2O4 溶液 | 30 mL 0.01 molL-1 KMnO4 酸性溶液 |
② | 20 mL 0.2 molL-1 H2C2O4 溶液 | 30 mL 0.01 molL-1 KMnO4 酸性溶液 |

(1)检验上图装置气密性的最简便方法为:____________。
(2)H2C2O4溶液与酸性 KMnO4溶液反应的化学方程式为____________。
(3)该实验探究的是___________因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是___________(填实验序号)。
(4)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________(若忽略溶液混合前后体积的变化)。
(5)小组同学发现反应速率总是如上右图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①__________、②_________、③K+对该反应有催化作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是 ( )
A.某特定反应的平衡常数仅是温度的函数
B.化学平衡发生移动,平衡常数必发生变化
C.其他条件一定时,平衡常数发生变化,化学平衡必定发生移动
D.催化剂不能改变平衡常数的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把3molA和2.5molB混合与2L密闭容器中,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
(1)x= 。
(2)平衡时C的浓度为多少?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)这些物质为什么归为一类,下列哪些物质还可以和它们归为一类 ( )
A. 75%的酒精溶液 B. 硝酸钠 C. Fe(OH)3胶体 D. 豆浆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com