
| A. | 甲烷分子中的两个氢原子被两个氯原子取代后,可以形成两种不同结构的有机物 | |
| B. | 乙烯完全燃烧生成CO2和H2O的物质的量之比为1:2 | |
| C. | 苯中碳碳键的键长均相等,证明苯中不存在单双键交替的结构 | |
| D. | 金属钠与乙醇反应时,金属钠在乙醇表面四处游动 |
分析 A.甲烷是正四面体结构,甲烷分子中两个H原子被取代后生成的二氯甲烷是四面体结构,二氯甲烷只有一种结构;
B.根据原子守恒判断生成二氧化碳和水的物质的量之比;
C.碳碳双键和碳碳单键键长不等;
D.钠密度大于乙醇而小于水.
解答 解:A.甲烷是正四面体结构,甲烷分子中两个H原子被取代后生成的二氯甲烷是四面体结构,则二氯甲烷只有一种结构,不存在同分异构体,故A错误;
B.乙烯分子中C、H原子个数之比为1:2,根据原子守恒判断生成二氧化碳和水的物质的量之比为1:1,故B错误;
C.碳碳双键和碳碳单键键长不等,苯中碳碳键的键长均相等,则证明苯中不存在单双键交替的结构,故C正确;
D.钠密度大于乙醇而小于水,所以金属钠与乙醇反应时,金属钠沉在乙醇底部,故D错误;
故选C.
点评 本题考查较综合,涉及方程式的计算、同分异构体、有机物结构和性质,为高频考点,侧重考查学生分析判断能力,注意原子守恒的灵活运用,注意Na和乙醇反应不如和水反应剧烈,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
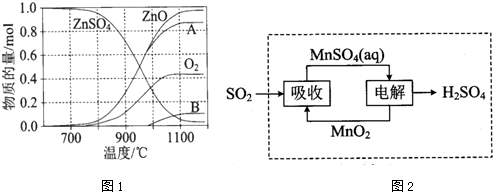
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
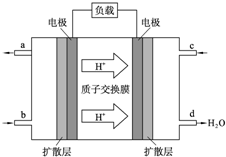 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 原子核外电子有4种不同的运动状态 |
| C | 元素原子的核外成对电子数是未成对电子数的2倍且有3个能级 |
| D | 元素原子的核外p电子数比s电子数少1 |
| E | E原子的第一至第四电离能如下:I1=738 kJ•mol-1 I2=1451 kJ•mol-1 I3=7733 kJ•mol-1 I4=10540 kJ•mol-1 |
| F | 第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满 |
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com