
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1L1mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B.78g 苯含有C=C双键的数目为3NA
C.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
科目:高中化学 来源: 题型:
A.B.C.D.E.F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;基态E原子p能级上有一对成对电子,C.F两种元素的原子最外层共有13个电子。回答下列问题:
(1)D.E.F中电负性最大的是 (填写元素符号)。
(2)写出D原子的外围电子排图为 。
(3)B.C.E分别与A形成的化合物中沸点最高的是 。
(4)C与D形成的化合物的化学式是 ,请写出其溶于NaOH的离子方程式 ;
(5)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验探究是体验知识产生或形成过程的基本途径。下面是某同学探究实验报告的一部分,请填空:
实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
| 实验步骤 | 实验结论 |
| ①NaCl溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
(1)完成该实验需要用到的仪器是________________________________;
(2)CCl4在实验中所起的作用是______________________________;
(3)在实验②中四氯化碳层颜色变化过程为________________________ ________________________________________________;
(4)该同学的实验缺陷是_______________________________________________,
改进的办法是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
填空
(1)1 mol O原子中含有______________个O原子。
(2)3 mol H2SO4中含有__________个H2SO4,含有____________个H原子。
(3)4 mol O2含有__________ mol O原子,64 mol e-。
(4)6.02×1024个Na+的物质的量是________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法正确的是
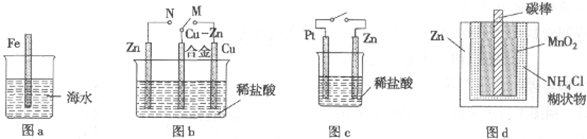
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu—Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2被氧化引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO +4H++3e-―→NO+2H2O, KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
+4H++3e-―→NO+2H2O, KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
________________________________________________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质发生反应时,生成物不因反应条件(浓度、温度或催化剂等)的不同而不同的是
A.Cu与HNO3 B.CO与O2 C.Na与O2 D. C2H5OH与O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.铁是人类在生产、生活中最早使用的金属
B.金、银、铜是应用最广泛的金属材料
C.钛被誉为“21世纪的金属”,应用前景很广阔
D.铜是导电性、导热性最好的有色金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com