
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:分析 (1)根据电池反应式知,失电子化合价升高的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的化合价降低的可溶性反应物作电解质溶液,据此设计原电池;
(2)原电池中,易失电子的电极铜为负极,银作正极,正极上得电子发生还原反应;负极发生氧化反应;
(3)电子从负极沿导线流向正极;
(4)根据总的电极反应式得:Cu~~2Ag.
解答 解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,所以X电极材料是Cu,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3 ;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,X电极是铜电极发生氧化反应生成铜离子,
故答案为:正; Ag++e-=Ag;氧化反应;
(3)电子从负极Cu沿导线流向正极Ag,故答案为:流向;
(4)根据总的电极反应式得:
Cu~~~~~2Ag
64g 216g
1.6g m
所以$\frac{64g}{1.6g}=\frac{216g}{m}$,解之得m=5.4g,故答案为:5.4.
点评 本题考查了原电池设计,明确原电池原理是解本题关键,根据电池反应式中得失电子的物质选取负极材料和电解质,知道原电池中正负极的判断方法,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 升高温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,Mg(OH)2固体在20 ml 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的小 | |
| C. | 25℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 | |
| D. | 25℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
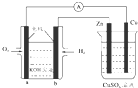
| A. | 该装置中Zn极为阳极 | |
| B. | 一段时间后铜片上质量增加 | |
| C. | a极反应的电极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 当铜极的质量变化为32g时,b极上消耗的O2的体积为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6mol | B. | 3.2mol | C. | 3.6mol | D. | 2.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题:
某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离环己烷和水的混合液体 | |
| B. | 用浓氨水洗涤做过银镜反应的试管 | |
| C. | 分馏石油时,温度计的末端必须插入液面下 | |
| D. | 配制新制Cu(OH)2溶液时,在2mL10% CuSO4溶液中滴入几滴2%NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com