
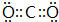 .
.分析 化合物YX2、ZX2中,X,Y,Z都是前三周期的元素,Z是X的同族元素,ZX2中Z的质量分数为50%,则Z为S元素、X为O元素;Y元素最外层电子数是K层所能容纳电子数的2倍,Y原子最外层电子数为4,Y为C或Si,据此解答.
解答 解:化合物YX2、ZX2中,X,Y,Z都是前三周期的元素,Z是X的同族元素,ZX2中Z的质量分数为50%,则Z为S元素、X为O元素;Y元素最外层电子数是K层所能容纳电子数的2倍,Y原子最外层电子数为4,Y为C或Si.
(1)YX2是SiO2或CO2,其中SiO2属于原子晶体,CO2属于分子晶体,故熔沸点SiO2>CO2,CO2的电子式为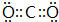 ,故答案为:SiO2;CO2;
,故答案为:SiO2;CO2;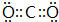 ;
;
(2)SO2 中S原子价层电子对数=2+$\frac{6-2×2}{2}$=3,故S原子采取sp2杂化,故答案为:sp2;
(3)YZ2分子应是CS 2分子,与二氧化碳分子结构类似,属于直线型对称结构,分子中正负电荷重心重合,属于非极性分子,故答案为:非极性.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握常见元素化合物,注意对基础知识的理解掌握.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子.回答下列问题:
前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com