
分析 0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子,X离子得电子被还原,电子的物质的量是1mol,二者的物质的量之比等于微粒个数之比,则每个X离子得到2个电子生成原子或单质;
0.4gX的单质与足量盐酸充分反应放出0.02g氢气,则X是金属元素,其阳离子为二价阳离子,X与盐酸反应生成金属阳离子时,根据转移电子守恒得n(H2)=n(X),M(X)=$\frac{0.4g}{\frac{0.02g}{2g/mol}}$=40g/mol,其相对原子质量为40,X中质子数和中子数相等,则X质子数是20,为Ca元素;
Y元素的阴离子结构与氩原子结构相同,它的气态氢化物水溶液是强酸,则Y为Cl元素,
再结合题目分析解答.
解答 解:0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子,X离子得电子被还原,电子的物质的量是1mol,二者的物质的量之比等于微粒个数之比,则每个X离子得到2个电子生成原子或单质;
0.4gX的单质与足量盐酸充分反应放出0.02g氢气,则X是金属元素,其阳离子为二价阳离子,X与盐酸反应生成金属阳离子时,根据转移电子守恒得n(H2)=n(X),M(X)=$\frac{0.4g}{\frac{0.02g}{2g/mol}}$=40g/mol,其相对原子质量为40,X中质子数和中子数相等,则X质子数是20,为Ca元素;
Y元素的阴离子结构与氩原子结构相同,它的气态氢化物水溶液是强酸,则Y为Cl元素,
(1)通过以上分析知,X、Y两元素的名称分别是钙、氯,分别位于第四周期第IIA族、第三周期第VIIA族,
答:X、Y两元素的名称及在周期表中的位置分别是钙、氯、第四周期第IIA族、第三周期第VIIA族;
(2)X、Y通过得失电子形成离子化合物氯化钙,其形成过程为 ,
,
答:氯化钙的形成过程为 .
.
点评 本题考查化学方程式的计算、元素推断等知识点,侧重考查学生推断计算能力,正确判断元素是解本题关键,注意题干信息的获取、加工和利用,题目难度中等.


科目:高中化学 来源: 题型:解答题
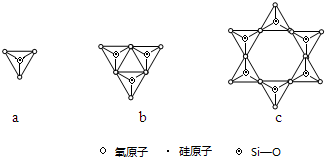
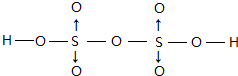 (配位键须注明).
(配位键须注明).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属镁及其化合物在生活、工农业生产等方面有广泛的应用.
金属镁及其化合物在生活、工农业生产等方面有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
, ,稳定性较好.
,稳定性较好.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
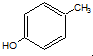 对甲基苯酚与溴水反应
对甲基苯酚与溴水反应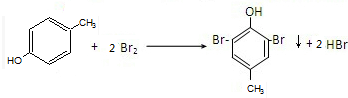
 环已二烯与氯气1,4加成
环已二烯与氯气1,4加成 +Cl2$\stackrel{催化剂}{→}$
+Cl2$\stackrel{催化剂}{→}$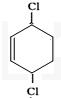
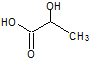 乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$
乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$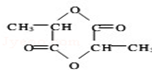 +2H2O
+2H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+的结构示意图: | |
| B. | 乙酸的化学式:CH3CH2OH | |
| C. | 硫酸钾的电离方程式:K2SO4═${K}_{2}^{+}$+${SO}_{4}^{2-}$ | |
| D. | N2的结构式:N≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol37Cl2和16g O2 | B. | 5.6L N2(标准状况)和11g CO2 | ||
| C. | 20g D2O和10g H2 | D. | 224mL D2和0.1mol N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com