
工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)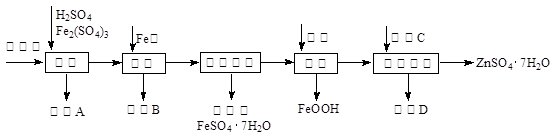
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子是Cd2+,所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
(16分)
(1)S(2分)
(2)做氧化剂(2分) Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S↓(3分)
(3)4Fe2++O2+6H2O=4FeOOH+8H+(3分)
增大空气与溶液的接触面积,加快反应速率(2分)
(4)Zn(锌)(2分) (5)60℃条件下蒸发浓缩、降温结晶(2分)
解析试题分析:(1)闪锌矿组成元素中只有硫、氧两种非金属元素,氧气是无色非金属单质,硫黄是黄色非金属单质,则滤渣A的主要成分是S;(2)浸取时,金属硫化物中硫元素由—2升为0价,则金属硫化物是还原剂,由此推导出硫酸铁中铁元素由+3降为+2价,即硫酸铁是氧化剂;硫化锌与硫酸铁反应生成硫酸亚铁、硫酸锌、硫黄,根据最小公倍数法配平,则Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S↓;(3)浓缩结晶的母液含有饱和硫酸亚铁溶液,亚铁离子被氧化为FeOOH时,铁元素化合价由+2升为+3,则空气中氧气是氧化剂,氧元素由0降为—2价,根据电子、电荷、原子守恒原理配平,则该反应为4Fe2++O2+6H2O=4FeOOH+8H+;在空气入口处设计了一个类似淋浴喷头的装置,目的是增大空气与溶液的接触面积,加快反应速率;(4)根据置换反应原理,应选择比Cd活泼的金属,根据除杂原则,除去Cd2+的同时只能引入Zn2+,不能引入别的金属阳离子,因此物质C为锌(Zn);(5)读表可知,0~100℃,硫酸锌的溶解度先随温度升高而增大,后随温度升高而减小,或者60℃左右硫酸锌的溶解度最大,因此在60℃左右蒸发浓缩、冷却结晶、过滤、干燥,可以制备硫酸锌晶体。
考点:考查物质制备工艺流程,涉及硫黄的物理性质、氧化还原反应、化学方程式、离子方程式、影响化学反应速率的因素、除杂试剂的选择、溶解度表、晶体制备方法和原理等。


科目:高中化学 来源: 题型:填空题
(12分)【化学——化学与技术】
资源开发、材料制备及工农业生产等都离不开化学。请回答下列问题:
(1)工业制肥皂时,在皂化反应结束后需要在混合物中加入饱和食盐水。加入饱和食盐水的目的是 。
(2)Al2O3的熔点高达2050oC,工业上为了降低能量消耗,在金属铝的冶炼中通常采取的措施是 。
(3)工业上合成氨所需的氮气来源于 ,氢气来源于 ,写出工业上在催化剂作用下制取氢气的其中一个化学方程式 。
(4)工业制硫酸时,SO3的生成是在 (填设备名称)中进行的,工业上常采用浓硫酸吸收SO3,而不直接用水吸收的原因是 。在吸收塔中,为提高SO3的吸收率所采取的措施为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[化学-选修化学与技术](15分)
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮化硅( Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
I.工业上有多种方法来制备氮化硅,常见的方法有:
方法一:直接氮化法:在1300℃-1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为
。
方法二:化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HC1,与方法一相比,用此法制得的氮化硅纯度较高,其原因是 .
方法三:Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体(填分子式)________;然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为 。
II.工业上制取高纯硅和四氯化硅的生产流程如下:
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是(写名称) 。
(2)写出焦炭与原料B中的主要成分反应的化学方程式: 。
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu (填“能”或“不能”),写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极: ;阴极: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成为是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下: 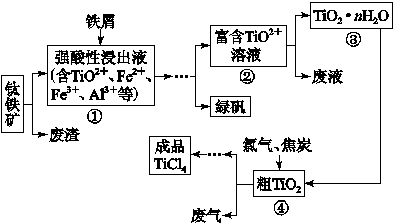
回答下列问题:
往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可以制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4的,可采用 方法。
| | TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有 (任写一种方法)。碳酸锶与盐酸反应的离子方程式为 。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为 。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水 B.氢氧化钠 C. 氢氧化锶粉末 D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和 (填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+ 浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于 mol/L。
| | SrSO4 | BaSO4 | Sr(OH)2 |
| Ksp | 3.3×10—7 | 1.1×10—10 | 3.2×10—4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
合成氨工业、硫酸工业的生产工艺流程大致为:
合成塔和接触室中的反应分别为:N2(g)+3H2(g)  2NH3(g) △H﹤0; 2SO2(g)+O2(g)
2NH3(g) △H﹤0; 2SO2(g)+O2(g)  2SO3(g) △H﹤0
2SO3(g) △H﹤0
(1)写出流程中设备的名称:B ,X 。
(2)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是 。
(3)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的是 (填序号)。
①硫酸工业 ②合成氨工业 ③硝酸工业
(4)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是 。
(5)工业生产中常用氨——酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
城市的环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源;d处在下游,附近有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的是( )
| A.造成X河污染的主要污染源最可能分布在bc段 |
| B.工业生活污水、固体废弃物等可能是造成X河污染的污染源 |
| C.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致 |
| D.该城市建设硫酸厂时,综合考虑诸多因素选址在b处最合理 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学工业在经济发展中的作用举足轻重。下列有关工业生产的叙述中,正确的是 ( )
| A.硫酸生产中常采用高压条件来提高SO2的转化率 |
| B.合成氨中采用及时分离液态氨来提高反应速率 |
| C.电解精炼铜中,溶液中c(Cu2+)基本保持不变 |
| D.氯碱工业中阳极得到氢氧化钠和氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com