


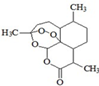
 ,青蒿素分子式为C15H22O5.
,青蒿素分子式为C15H22O5. 分析 (1)乙酸结构简式为CH3COOH,官能团为-COOH;
(2)在乙酸中的羟基之间加一个O即为过氧乙酸;
(3)分子式相同,结构不同的化合物互为同分异构体;
(4)结构相似,分子组成上相差一个或若干个CH2原子团的化合物,互为同系物,同系物必须是同一类物质(含有相同且数量相等的官能团);
(5)由结构可知分子式.
解答 解:(1)乙酸结构简式为CH3COOH,官能团为-COOH,名称为羧基,故答案为:羧基;
(2)在乙酸中的羟基之间加一个O即为过氧乙酸,B符合,故答案为:B;
(3)分子式相同,结构不同的化合物互为同分异构体,则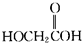 、
、 、
、 的分子式与过乙酸相同,结构不同,互为同分异构体,即A、E、H为过乙酸的同分异构体,故答案为:AEH;
的分子式与过乙酸相同,结构不同,互为同分异构体,即A、E、H为过乙酸的同分异构体,故答案为:AEH;
(4)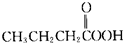 与过乙酸属于同一类物质,分子组成上相差2个CH2原子团,互为同系物,故答案为:F;
与过乙酸属于同一类物质,分子组成上相差2个CH2原子团,互为同系物,故答案为:F;
(5)青蒿素化学结构式如图 ,青蒿素分子式为C15H22O5,故答案为:C15H22O5.
,青蒿素分子式为C15H22O5,故答案为:C15H22O5.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、官能团、性质为解答的关键,侧重分析与应用能力的考查,注意同分异构体及同系物的判断,题目难度不大.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | O、F、H的原子半径依次减小 | |
| B. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| C. | 干冰、钠、冰的熔点依次降低 | |
| D. | 金属Na、Mg、Al的硬度依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:5 | B. | 3:1 | C. | 5:1 | D. | 7:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:2X(g)+Y(g)?a Z(g),在T1温度时,在体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答:
已知:2X(g)+Y(g)?a Z(g),在T1温度时,在体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| B. | 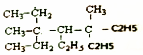 进行一氯取代反应后,能生成6种沸点不同的产物 进行一氯取代反应后,能生成6种沸点不同的产物 | |
| C. | 正戊烷分子中所有的碳原子均在一条直线上 | |
| D. | 分子式为C3H6、C6H12的两种有机物一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、MnO4- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Br-、Cu2+ | D. | Ca2+、Na+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com