
| A、Fe2+ | B、Fe3+ | C、Al3+ | D、Mg2+ |


科目:高中化学 来源: 题型:阅读理解
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 滴入1滴(或少量)品红 滴入1滴(或少量)品红 再滴入过量2mol/L盐酸,振荡 再滴入过量2mol/L盐酸,振荡 . |
若品红褪色(或有气泡),则“吸收液”中存在 SO32-. 若品红褪色(或有气泡),则“吸收液”中存在 SO32-. 若品红不褪色(或无有气泡),则“吸收液”中不存在 SO32- 若品红不褪色(或无有气泡),则“吸收液”中不存在 SO32- |
| 步骤3: 用试管取适量滤液 用试管取适量滤液 向其中滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 向其中滴入过量的1mol/LBa(OH)2溶液[或滴入1滴(或少量)品红溶液,再滴入2-3滴(或过量)的2mol/L盐酸],振荡 . |
若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-. 若出现白色沉淀(或品红溶液褪色,或有气泡),则“吸收液”中存在 HSO3-. 若不出现白色沉淀(或品红溶液不褪色,或没有气泡),则“吸收液”中不存在 HSO3-. 若不出现白色沉淀(或品红溶液不褪色,或没有气泡),则“吸收液”中不存在 HSO3-. |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 预期实验现象 | 预期实验结论 |
分别取30mL 0.5mol?L-1 MgCl2、AlCl3溶液于烧杯中,充分混合 分别取30mL 0.5mol?L-1 MgCl2、AlCl3溶液于烧杯中,充分混合 |
无现象 无现象 |
溶液中水解不能生成沉淀 溶液中水解不能生成沉淀 |
向混合溶液中滴入2滴酚酞试液,逐滴加入1mol?L-1 NaOH溶液 向混合溶液中滴入2滴酚酞试液,逐滴加入1mol?L-1 NaOH溶液 |
当溶液中生成大量的白色絮状沉淀后溶液的颜色不变 当溶液中生成大量的白色絮状沉淀后溶液的颜色不变 |
产生的沉淀可能是氢氧化铝、氢氧化镁或二者的混合物 产生的沉淀可能是氢氧化铝、氢氧化镁或二者的混合物 |
将上述混合溶液过滤,洗涤,再向滤渣中加入过量的1mol?L-1 NaOH溶液 将上述混合溶液过滤,洗涤,再向滤渣中加入过量的1mol?L-1 NaOH溶液 |
滤渣全部溶解 滤渣全部溶解 |
产生的沉淀只有氢氧化铝 产生的沉淀只有氢氧化铝 |
空 空 |
空 空 |
空 空 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①另取0.5mol?L-1 MgCl2、AlCl3溶液各30mL于不同烧杯中 | 溶液中无现象 溶液中无现象 |
水溶液中无氢氧化镁、氢氧化铝沉淀生成 水溶液中无氢氧化镁、氢氧化铝沉淀生成 |
| ②向0.5mol?L-1 AlCl3溶液中逐滴加入NaOH溶液至刚好反应完全 | 产生沉淀,沉淀溶解,沉淀消失 | 产生氢氧化铝沉淀,加过量的氢氧化钠溶液后氢氧化铝又溶解 |
| ③将MgCl2溶液全部倒入②反应后的溶液中 | 产生大量白色沉淀 | 二者混合时相互促进水解最终生成Mg(OH)2和Al(OH)3沉淀. 二者混合时相互促进水解最终生成Mg(OH)2和Al(OH)3沉淀. |
查看答案和解析>>
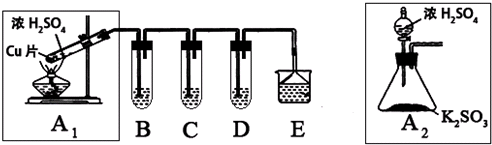
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(写离子方程式)_________。向上述溶液中滴入过量的CaCl2溶液,观察到的现象是__________________。
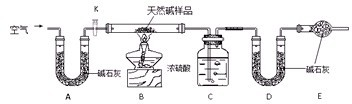
Ⅱ.某天然碱的组成为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数)。现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为

请回答:
(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明_______________________。
(2)NaHCO3受热分解的化学反应方程式为________________________________________。
(3)E处碱石灰的作用是__________________________________________________。
(4)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是__________________。
(5)实验结束后称得洗气瓶C质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸钠和碳酸氢钠是重要的工业原料。某校为探究它们的性质并测定某天然碱的成分进行了下述实验。
Ⅰ.向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(结合离子方程式简要说明)___________ 向上述溶液中滴入过量CaC12溶液,观察到的现象是 ,原因是(结合离子方程式简要说明) 。
Ⅱ.某天然碱的组成为aNa2CO3?bNaHCO3?cH2O(a、b、c为正整数)。现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为7.3g。实验时忽略装置内空气中的CO2和水蒸气。

请回答:
(1)NaHCO3受热分解化学反应方程式为 。
A处碱石灰的作用是 。
(2)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是
。
(3)实验结束后称得洗气瓶C质量增加0.9g,U型管D质量增加1.1g,则该天然碱的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com