

分析 (1)右室中混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,由图可知,平衡(I)降低温度达新平衡平衡(Ⅱ),隔板由2.8处移至2.6处,左室的气体的物质的量减小,降低温度平衡向正反应移动;
(2)降低温度,右室的平衡一定移动,气体总的物质的量不变,X的含量一定变化;
(3)右室的混合物总物质的量不变为2mol,左右两室的压强、温度相等,同温同压下,体积之比等于物质的量之比,据此计算平衡(I)中左室混合气体总的物质的量,利用差量法计算参加反应A的物质的量、生成的C的物质的量,进而计算A的转化率、C的体积分数;
(4)右室中混合气体总物质的量不变,温度恒定,则达到平衡I时,体系压强与反应开始时体系压强之比等于体积之比.
解答 解:(1)右室中混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,由图可知,平衡(I)降低温度达新平衡平衡(Ⅱ),隔板由2.8处移至2.6处,左室的气体的物质的量减小,降低温度平衡向正反应移动,降低温度平衡向放热反应移动,故该反应正反应为放热反应,则△H<0,故答案为:<;
(2)降低温度,右室的平衡一定移动,气体总的物质的量不变,E的含量一定变化,平衡(I)和平衡(Ⅱ)中,E的体积分数一定不相等,故选:b;
(3)右室中混合物总物质的量不变为2mol,左右两室的压强、温度相等,同温同压下,体积之比等于物质的量之比,平衡(I)中左室混合气体总的物质的量为$\frac{2.8}{2.2}$×2mol=$\frac{28}{11}$mol,令参加反应的A的物质的量为amol,则:
A(g)+2B(g)?2C(g) 物质的量减少△n
1 2 1
$\frac{5}{11}$mol $\frac{10}{11}$mol 3mol-$\frac{28}{11}$mol=$\frac{5}{11}$mol
所以A的转化率为$\frac{\frac{5}{11}mol}{1mol}$=$\frac{5}{11}$,
C的体积分数为$\frac{\frac{10}{11}mol}{\frac{28}{11}mol}$=$\frac{5}{14}$
故答案为:$\frac{5}{11}$;$\frac{5}{14}$;
(4)右室中混合气体总物质的量不变,温度恒定,则达到平衡I时,体系压强与反应开始时体系压强之比等于体积之比,即压强之比为2:(5-2.8)=10:11,
故答案为:10:11.
点评 本题考查化学平衡计算与化学平衡移动,清楚左右两室的温度、压强相同,体积之比等于物质的量之比是解题关键,难度中等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测量新制氯水的pH | |
| B. | 用10mL量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用量筒量取20mL0.5000 mol•L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.1000 mol•L-1H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是实验室制取溴苯的装置图
如图是实验室制取溴苯的装置图查看答案和解析>>
科目:高中化学 来源: 题型:填空题
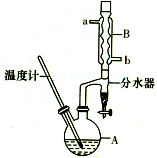 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:| 相对分子质量 | 沸点/℃ | 密度/g/cm3 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1氨水中加入适量NH4Cl(s),则混合液中c(NH4+)与c(NH3•H2O)之比增大 | |
| B. | 25℃时,0.1mol•L-1氨水和0.05 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 0.1mol•L-1 CH3COOH溶液中,c(CH3COO-)=c(H+) | |
| D. | 向0.1mol•L-1KNO3溶液中,滴加稀盐酸至溶液pH=5,此时混合液中c(K+)<c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于可逆反应:H2(g)+Br2(g)?2HBr(g)达到化学平衡后,增大压强时,混合气体颜色变深 | |
| B. | 合成氨工业中温度选择为500°C | |
| C. | 配制Al2(SO4)3溶液时加入少量稀硫酸 | |
| D. | 合成氨工业采用循环操作,可提高原料利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com