
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
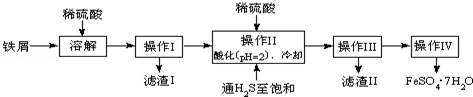
分析 用稀硫酸溶解铁和氧化铁的混合物,并通H2S利用沉淀法可除去其中混有的Sn2+,考虑到Fe2+易水解和易氧化,因此要保持溶液处于酸环境同时铁粉过量,对所得硫酸亚铁溶液可以通过蒸发浓缩并冷却结晶的方法得到,经过洗涤干燥后再通过滴定法测定样品的纯度,
(1)Fe和Fe2O3在硫酸溶液中发生的反应包括铁和氧化铁与稀硫酸的反应及多余的铁将三价铁还原成二价铁;
(2)依据流程关系图分析,通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;
(3)操作IV的目的是从滤液中析出绿矾晶体,利用蒸发浓缩,结晶洗涤得到晶体;
(4)操作IV得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(5)常温下Ksp[Fe(OH)2]=1.64×10-14=c(Fe2+)×c2(OH-),Fe2++2H2O?Fe(OH)2+2H+的平衡常数K=$\frac{{c}^{2}({H}^{+})}{c(F{e}^{2+})}$,再结合Kw进行计算.
解答 解:(1)铁与稀硫酸反应的离子方程式为Fe+2H+=Fe2++H2↑,氧化铁溶解在稀硫酸中的离子反应式为Fe2O3+6H+=2Fe3++3H2O,Fe3+继续溶解铁的离子反应式为2Fe3++Fe=3Fe2+,故答案为:Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+;
(2)通入硫化氢至饱和除沉淀Sn2+外,因硫化氢具有强还原性,可以防止亚铁离子被氧化,已知在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
故答案为:防止Fe2+被氧化;防止Fe2+离子生成沉淀;
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发、结晶、过滤、洗涤,
故答案为:蒸发浓缩;冷却结晶;
(4)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,
故答案为:降低洗涤过程中FeSO4•7H2O的损耗;
(5)Fe2++2H2O?Fe(OH)2+2H+的平衡常数K=$\frac{{c}^{2}({H}^{+})}{c(F{e}^{2+})}$=$\frac{{c}^{2}({H}^{+}){c}^{2}(O{H}^{-})}{c(F{e}^{2+}){c}^{2}(O{H}^{-})}$=$\frac{(1×1{0}^{-14})^{2}}{1.64×1{0}^{-14}}$=6.1×10-15,
故答案为:6.1×10-15.
点评 本题是工业制备绿矾的流程探究,涉及反应原理,考查了铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 用激光笔照射煮沸过的FeCl3溶液可观察到明亮光路 | |
| B. | 大雾天气用汽车远光灯照射前方常出现明亮光路 | |
| C. | 明矾可用作净水剂 | |
| D. | 臭氧、Cl2均可用于水的消毒净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡向右移动 | C. | B的转化率升高 | D. | C的体积分数降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和氮的许多化合物在工农业生产和生活中有重要的作用.
碳和氮的许多化合物在工农业生产和生活中有重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
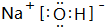 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA电离出的c(H+)与水电离出的c(H+)之比为108 | |
| B. | 升高温度,溶液的pH减小 | |
| C. | 溶液的pH=4 | |
| D. | HA的电离平衡常数约为l×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用石斧解剖 | B. |  早期的农业耕作 | C. |  简单机械织布 | D. |  祥云火炬燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
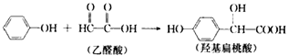
| A. | 该反应是加成反应 | |
| B. | 1 mol羟基扁桃酸能与3mol NaOH反应 | |
| C. | 乙醛酸与H2加成的产物能在催化剂作用下形成高分子化合物 | |
| D. | 苯酚和羟基扁桃酸遇上FeCl3溶液都会显色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com