
| A.酸A中X的非金属性比酸B中Y的非金属性强 |
| B.酸A中X与酸B中Y在同一周期,且X在Y之后 |
| C.酸A与酸B的铵盐溶液反应生成酸B |
| D.酸A具有强氧化性,酸B没有强氧化性 |
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:不详 题型:填空题
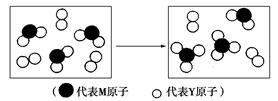
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
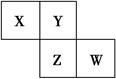
| A.只由这四种元素不能组成有机化合物 |
| B.最高价氧化物对应的水化物的酸性W比Z弱 |
| C.Z的单质与氢气反应较Y剧烈 |
| D.X、Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| ⅠA | ⅡA | ⅢA | ⅣA |
| | | | Q |
| X | | Y | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相 关 信 息 |
| X | X最高价氧化物的水化物与气态氢化物可以形成一种盐 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 KCl (l)+NaAlSi3O8 (s)。
KCl (l)+NaAlSi3O8 (s)。| 时间(h) 钾元素 温度 熔出率 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | | |||||
| | | | N | | F | |
| Mg | Al | | | S | Cl | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第9列元素中有非金属元素 |
| B.只有第二列的元素原子最外层电子排布为ns2 |
| C.第四周期第8列元素是铁元素 |
| D.第15列元素原子的最外层电子排布为ns2np5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com