
分析 (1)Fe(OH)2Cl和盐酸反应生成盐和水;
(2)氯气具有强氧化性,能把亚铁离子氧化生成铁离子;
(3)①亚铁离子和铁氰化钾溶液反应生成蓝色沉淀;
②碘离子和铁离子发生氧化还原反应生成亚铁离子和碘;
③铁离子能使硫氰化钾溶液呈红色,亚铁离子能和铁氰化钾溶液反应生成蓝色沉淀.
解答 解:(1)Fe(OH)2Cl和盐酸反应生成盐和水,离子反应方程式为:Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O,
故答案为:Fe(OH)2Cl+2H+=Fe3++Cl-+2H2O;
(2)氯气具有强氧化性,能被还原性的亚铁离子氧化生成铁离子,铁离子和硫氰化钾溶液反应生成络合物而使溶液呈血红色,离子反应方程式为:2Fe2++Cl2=2Cl-+2Fe3+,
故答案为:2Fe2++Cl2=2Cl-+2Fe3+;
(3)①亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,这是亚铁离子的特征反应,所以试管2中滴加K3[Fe(CN)6]检验的离子是Fe2+,故答案为:Fe2+;
②试管1说明溶液中含有铁离子,试管2说明溶液中含有亚铁离子,铁离子和碘离子反应生成亚铁离子和碘单质,导致溶液中还含有碘单质,所以黄色溶液中含有的溶质微粒有K+、Cl- 和Fe3+、Fe2+、I2,
故答案为:Fe3+、Fe2+、I2;
③碘化钾溶液和少量的氯化铁溶液反应,溶液中存在铁离子和亚铁离子,说明Fe3+与I-的反应为可逆反应,
故答案为:Fe3+与I-的反应为可逆反应.
点评 本题考查了亚铁离子和铁离子之间的相互转化,难度较大,铁离子和亚铁离子的检验是高考的热点,根据铁离子和亚铁离子的特征反应来检验即可.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
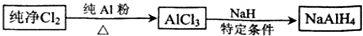
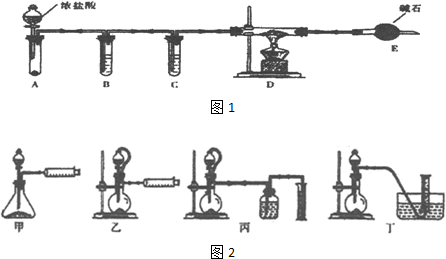
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
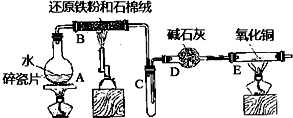
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2<Q1<92.4 | B. | 2Q2=Q1=92.4 | C. | Q1<Q2<92.4 | D. | Q2=Q1<92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
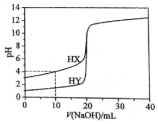 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )| A. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(H+)>c(OH-) | |
| B. | V(NaOH)=20.00 mL时,两份溶液中,c(X-)>c(Y-) | |
| C. | V(NaOH)=20.00 mL时,c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Y-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe2+>I2 | B. | Cl2>I2>Fe3+ | C. | Cl2>Fe3+>I2 | D. | Fe2+>Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com