
【题目】(1)以下为中学化学常见的几种物质①NaOH溶液②铜丝③液氯④盐酸⑤稀硫酸⑥氨水⑦CO2⑧熔融NaCl⑨蔗糖晶体⑩酒精。属于非电解质的是________,属于电解质的是________。
(2)工业上可用浓氨水检查氯气管道是否漏气。若有Cl2漏出,与浓氨水接触会有白烟生成,同时产生一种无毒、无可燃性、不污染大气的气体。有关的化学方程式是________:。该反应中氧化剂和还原剂的物质的量之比为________。
(3)铁酸钠(Na2FeO4)是水处理过程中一种新型的净水型,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+。
①配平制取铁酸钠的化学方程式:____Fe(NO3)3+____NaOH+ ____Cl2——____Na2FeO4 +____NaNO3+____NaCl+____H2O
②用单线桥法标出反应中电子转移的方向和数目____。
【答案】⑦⑨⑩ ⑧ 3Cl2 + 8NH3 = 6NH4Cl+N2 3:2 2 16 3 2 6 6 8 
【解析】
(1)①NaOH溶液中含有自由移动的离子,所以能导电,但氢氧化钠溶液是混合物,所以既不是电解质也不是非电解质;②铜丝 中含有自由移动的电子,所以能导电,但铜丝是单质,所以它既不是电解质也不是非电解质;③液氯是单质,既不是电解质也不是非电解质; ④盐酸是氯化氢水溶液,是混合物既不是电解质也不是非电解质;⑤稀硫酸是混合物既不是电解质也不是非电解质;⑥氨水是混合物既不是电解质也不是非电解质;⑦CO2是非金属氧化物,属于非电解质;⑧熔融NaCl是盐,属于纯净物,是电解质;⑨蔗糖晶体是有机物,水溶液和熔融状态下都不能导电,属于非电解质;⑩酒精有机物,水溶液和熔融状态下都不能导电,属于非电解质;属于非电解质的是⑦⑨⑩;属于电解质的是⑧;
(2)若有Cl2漏出,与浓氨水接触会有白烟生成,白烟是氯化铵晶体,同时又氮气生成,方程式为:3Cl2 + 8NH3 = 6NH4Cl+N2;NH3中N从-3价升到N2中的0价,为还原剂,NH4Cl中N依然为-3价,不变,所以还原剂分子为2,Cl2中Cl从0价降到NH4Cl中-1价,为氧化剂,氧化剂分子个数为3个,所以氧化剂和还原剂的物质的量之比 3:2;
(3)根据电子守恒配平铁从正三价升高到正六价转移3个电子,氯气从0价到-1转移2个电子,最小公倍数是6,即可配平为:2Fe(NO3)3+16NaOH+ 3Cl2=2Na2FeO4 +6NaNO3+6NaCl+8H2O。用单线桥法标出反应中电子转移的方向和数目为:


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】乙醛酸(![]() )是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是
)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是
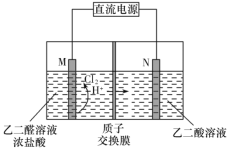
A. 若有2 mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为2 mol
B. M电极上的电极反应式为:2Cl 2e =Cl2↑
C. 电解一段时间后,N极附近溶液的pH变大
D. M极与电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体配制240mL 1.00mol/L的NaOH溶液,回答下列问题:
(1)配制1.00mol/L的NaOH溶液,应称取NaOH的质量_______g,需要的仪器为:量筒、烧杯,玻璃棒、托盘天平、砝码、______ 、______。
(2)容量瓶上需标有以下五项中的_____________________;
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
F.用胶头滴管加水至溶液凹液面与刻度线相切
(4)下列配制的溶液浓度偏低的是____________
A.称量NaOH时,将NaOH放在纸上称重
B.配制前,容量瓶中有少量蒸馏水
C.配制时,NaOH未冷却直接定容
D.加蒸馏水时不慎超过了刻度线
E.定容时俯视刻度线
F.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)__________________。
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
试样中肯定存在NH4+、Mg2+、SO42-和NO3-
试样中一定不含Al3+
试样中可能存在Na+、Cl-
该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是 ( )
A. HCO3的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 泡沫灭火器的原理:Al3++3HCO3- ![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
C. AgCl电离方程式:AgCl(s)![]() Ag+ (aq)+ Cl-(aq)
Ag+ (aq)+ Cl-(aq)
D. Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将30mL0.5mol/L的H2SO4溶液加水稀释到500mL后,从中取出50mL溶液的物质的量浓度为___。
(2)常温下,将20.0g14%的NaOH溶液跟30.0g24%的NaOH溶液混合,混合后得到1.2g/mL的混合液,试计算:
①混合后的溶液中NaOH的质量分数为___。
②混合后的溶液中NaOH的物质的量浓度为___mol/L。
③配制100mL同浓度溶液需要溶解___g的NaOH才能使其浓度与上述混合液浓度相等。
(3)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO和CO2的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的量相等的 CO 和 CO2 中,同温同压下所占的体积比为____,原子个数之比为______;
(2)1.8g水与_______mol硫酸所含的分子数相等,它们所含氧原子数之比是________,其中氢原子数之比是___________。
(3)3.2g某气体中含有的分子数约为3.01×1022,此气体的摩尔质量为________。
(4)可用于分离或提纯物质的方法有:
A 过滤 B 萃取 C 渗析 D 蒸馏 E 灼热氧化 F 分液.
如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
①除去淀粉溶液中的少量碘化钠________; ②提取溴水中的溴单质______;
③除去水中的Na+、![]() 、Cl-等杂质________; ④除去CuO中的Cu ______;
、Cl-等杂质________; ④除去CuO中的Cu ______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年12月8日,凌晨2时23分,我国在西昌卫星发射中心,嫦娥四号探测器搭载长征三号乙运载火箭成功发射,实现了世界首次月球背面软着陆和巡视探测,被认为是中国在工程技术和空间科学方面的双重跨越和创新。
I.肼(N2H4)又称联氨,常温时是一种可燃性的液体,可用作火箭燃料。
(1)已知在25℃、101kPa时,16g N2H4在氧气中完全燃烧生成氮气,放出312kJ的热量,则N2H4完全燃烧的热化学方程式是___________________________________________________。
II.如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
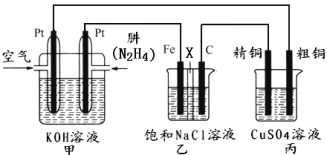
根据要求回答相关问题:
(2)甲装置中正极的电极反应式为:______________________________________。
(3)检验乙装置中石墨电极反应产物的方法是:___________________________。
(4)如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为___________g。
III.对金属制品进行抗腐蚀处理,可延长其使用寿命。该研究性学习小组又以肼(N2H4)─空气燃料电池为电源对铝材表面进行如下处理:
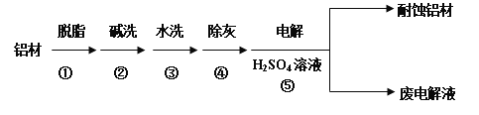
(5)流程⑤中以铝材为阳极,在H2SO4 溶液中电解,最终可在铝材表面形成氧化膜,该电解的阳极电极反应式为__________________________________。
(6)取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,其反应的离子方程式是__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com