
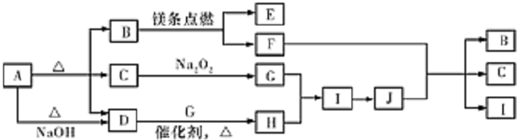
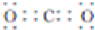 .
.分析 A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,B、D为常温下的气态化合物,C为常温下的液态化合物,C能和过氧化钠反应,则C为水,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,水和过氧化钠反应生成NaOH和O2,D能在催化剂条件下与G反应生成H,则D是NH3,G是O2,H是NO,I是NO2,J是HNO3,镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3,以此解答该题.
解答 解:A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,B、D为常温下的气态化合物,C为常温下的液态化合物,C能和过氧化钠反应,则C为水,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,水和过氧化钠反应生成NaOH和O2,D能在催化剂条件下与G反应生成H,则D是NH3,G是O2,H是NO,I是NO2,J是HNO3,镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3,
(1)A为NH4HCO3,A的名称为 碳酸氢铵,B为二氧化碳,B 的电子式为 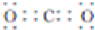 ,故答案为:碳酸氢铵;
,故答案为:碳酸氢铵; ;
;
(2)C为水,C+Na2O2→G的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,F+J→B+C+I为碳和浓硝酸在加热的条件下生成二氧化碳、二氧化氮和水,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)I是NO2,0.45mol I 与足量水反应,根据方程式3NO2+H2O=2HNO3+NO,可知转移电子的物质的量为 0.3 mol,
故答案为:0.3;
(4)容积为10mL 的试管中充满NO2和O2的混合气体,倒立于盛水的水槽中,水全部充满试管,则发生的反应为4NO2+2H2O+O2=4HNO3,根据反应方程式可知原混合气体中NO2与GO2体积比为4:1,所以10mL混合气体中NO2和O2的体积分别为8mL和2mL,
故答案为:8;2.
点评 本题考查了物质转化关系和物质性质的应用,本题涉及铁及其化合物,Al、HNO3、H2SO4等物质的性质应用内容,综合考查考生熟练运用元素化合物知识解决问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 100mL、1moL•L-1的ALCL3溶液中,含A13+的数目为0.1 NA | |
| B. | 足量Fe与0.1 mol CL2充分反应,转移的电子数目为0.3 NA | |
| C. | 在02参与的反应中,1mol 02作氧化剂时得到的电子数目一定为4 NA | |
| D. | 2.8g乙烯与一氧化碳的混合气体,所含分子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
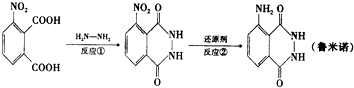
| A. | 1:2 | B. | 1:1 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “84”消毒液可以与福尔马林溶液混合使用 | |
| B. | NaClO的稳定性和漂白性都比HClO强 | |
| C. | 工业上在特定条件下电解饱和食盐水制得NaClO,原理为:NaCl+H2O═NaClO+H2↑ | |
| D. | NaClO溶液在空气中发生离子反应为:2ClO-+CO2+H2O═2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+H3PO4═NH4H2PO4 | |
| B. | 4NH3+5O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$4NO+6H2O | |
| C. | 2NH3+3Cl2═6HCl+N2 | |
| D. | NH3+NaH═NaNH2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
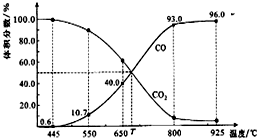 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如下图所示.下列说法正确的是( )| A. | 550℃时,若充入惰性气体,v正,?逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 该反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com