
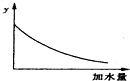
| A. | 溶液的pH | B. | 醋酸的电离平衡常数 | ||
| C. | 溶液的导电能力 | D. | 醋酸的电离程度 |
分析 醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,溶液的导电能力与离子浓度成正比,温度不变,醋酸的电离平衡常数不变,据此分析解答.
解答 解:A.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子浓度逐渐减少,溶液的pH逐渐增大,但始终小于7,故A错误;
B.温度不变,醋酸的电离平衡常数不变,故B错误;
C.醋酸是弱电解质,加水稀释促进醋酸电离,但酸的电离程度小于溶液体积增大程度,所以溶液中氢离子、醋酸根离子浓度逐渐减少,溶液的导电能力逐渐减小,故C正确;
D.加水稀释促进醋酸电离,则醋酸的电离程度增大,故D错误;
故选C.
点评 本题考查了弱电解质的电离,题目难度中等,明确加水稀释对醋酸电离程度的影响是解本题关键,知道溶液导电能力与离子浓度成正比,与电解质强弱无关,为易错点.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2 | B. | I2和 KCl | C. | I2.KCl和NaCl | D. | KCl和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与锌反应放出的氢气多 | |
| B. | 盐酸与锌反应放出的氢气多 | |
| C. | 醋酸与锌反应速率大 | |
| D. | 盐酸和醋分别与锌反应的速度一样大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
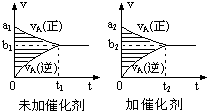 可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:
可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如图.对于下列命题:| A. | ②④⑤⑦ | B. | ①④⑥⑧ | C. | ②③⑤⑧ | D. | ①③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
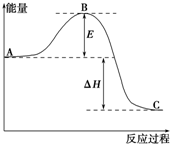 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NaA溶液pH=10 | B. | 0.01 mol•L-1 HA溶液的pH=4 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | HA溶液跟锌反应,放出H2很慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com