


科目:高中化学 来源:不详 题型:单选题
| A.二氧化硅和干冰晶体熔化时所克服的作用力类型相同 |
| B.分子晶体中一定含有共价键,离子晶体中一定含有离子键 |
| C.离子晶体都是强电解质 |
| D.检验淀粉是否已经全部水解时可取少量样品,向其中加入银氨溶液,水浴加热,若能生成银镜说明淀粉已经全部水解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
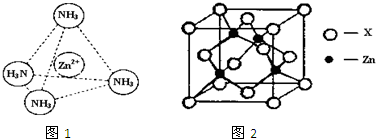
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SiO2晶体结构中,每个Si原子与2个O原子直接相连 |
| B.通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) |
| C.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
| D.1mol金刚石含4molC-C键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S→SO2→H2SO4→MgSO4 | B.Cu→CuCl2→Cu(NO3)2→Cu(OH)2 |
| C.Al→Al2O3→Al(OH)3→NaAlO2 | D.Na→Na2O→Na2CO3→NaCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.结晶法除去NaCl中少量的KNO3 | B.气球充入过量的空气,爆炸 |
| C.金属钠有强还原性,能与水反应 | D.氯化氢溶于水生成盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com