
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+
则下列说法正确的是 ( )
A.该反应中还原剂为Fe2+,O2、Fe(OH)3均为氧化产物
B.充分反应后可以看到白色沉淀和气体生成
C.标准状况下,每生成22.4 L O2,则有4 mol Na2O2被还原
D.若有4 mol Na2O2参加反应,则反应中共转移6NA个电子
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
根据FeS2+O2―→Fe2O3+SO2回答下列问题
(1)氧化剂________,还原剂________,氧化产物________,还原产物________。
(2)元素化合价升高的元素为________,元素化合价降低的元素为________。
(3)1“分子”还原剂化合价升高总数为________,1“分子”氧化剂化合价降低总数为________。
(4)配平后各物质的系数依次为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
配平下列方程式
(1)[2011·福建理综,23(6)]在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O===Ce(OH)4↓+________
查看答案和解析>>
科目:高中化学 来源: 题型:
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O===7X+5FeSO4+12H2SO4,下列说法正确的是 ( )
A.X的化学式为CuS,它既是氧化产物又是还原产物
B.5 mol FeS2发生反应,有10 mol电子转移
C.产物中的SO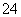 有一部分是氧化产物
有一部分是氧化产物
D.FeS2只作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。下列有关说法正确的是
A.氢制备工艺廉价易行,且储存方便
B.燃料电池车中能量转化率为100%
C.燃料电池车可直接将化学能转化为电能
D.利用热电厂的电能电解蒸馏水制备氢气是一种环保之举
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计如下图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)。
该电池工作时,下列说法正确的是
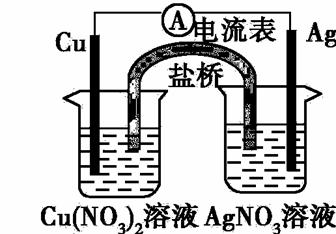
A.盐桥中的K+ 移向AgNO3溶液
B.负极反应为:Ag –e— =Ag+
C.该装置可将电能转化为化学能
D.在外电路中,电子由银电极流向铜电极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中各微粒浓度关系判定不正确的是
A.10mL 0.2 mol·L-1的氨水与l0mL 0.1 mol·L-1的盐酸充分反应混合后的溶液中,存在
c(NH4+)+c(NH3·H2O)=2c(Cl-)= 0.1 mol·L-1
B.已知酸性HF > CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:
c(Na+) - c(F-) > c(K+) - c(CH3COO-)
C.CH3COOK溶液中加入少量NaNO3固体后的碱性溶液一定有:
c(K+) + c(H+) = c(CH3COO-) + c(OH-)
D.NaHSO3溶液中一定有:c(Na+)> c(HSO3-)> c(SO32-)>c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E属于短周期元素,原子序数依次增大,已知A 与E同主族,B、C、D、E同周期,A与B可形成两种离子化合物甲和乙,在甲中A、B 离子的电子层结构相同;C的简单离子半径是同周期所有离子中最小的,高纯度的D单质可制造芯片;又知 C、D的单质都能与强碱溶液反应。
A、B、C、D、E属于短周期元素,原子序数依次增大,已知A 与E同主族,B、C、D、E同周期,A与B可形成两种离子化合物甲和乙,在甲中A、B 离子的电子层结构相同;C的简单离子半径是同周期所有离子中最小的,高纯度的D单质可制造芯片;又知 C、D的单质都能与强碱溶液反应。
(1)写出: A D (元素符号),乙 (化学式)。
(2)E元素在周期表中的位置是第 周期,第 族。
(3)画出B的原子结构示意图 ;
(4)C单质与NaOH溶液反应的离子方程式 ;
(5)举出C单质在工业上的一种重要用途(必须用化学方程式表示) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com