
【题目】某研究小组利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )

A.银片电极上发生还原反应,电极反应为Ag++e-=Ag
B.反应过程中电能全部转化为化学能
C.撤去电源并构成回路后,发生铜的吸氧腐蚀
D.当电镀一段时间后,将电源反接,铜牌不可能恢复如初
科目:高中化学 来源: 题型:
【题目】已知:①NH3(g)+HCl(g)=NH4Cl(s) ΔH1=-176 kJ/mol
②NH3(g)  NH3(aq) ΔH2=-35.1 kJ/mol
NH3(aq) ΔH2=-35.1 kJ/mol
③HCl(g)  HCl(aq) ΔH3=-72.3 kJ/mol
HCl(aq) ΔH3=-72.3 kJ/mol
④NH3(aq)+HCl(aq) =NH4Cl(aq) ΔH4=-52.3 kJ/mol
则NH4Cl(s)  NH4Cl(aq)的反应热ΔH5(kJ/mol)为( )
NH4Cl(aq)的反应热ΔH5(kJ/mol)为( )
A. 16.3B. -16.3C. 335.7D. -335.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做了如下4个实验:
①在铝盐溶液中逐滴加入稀氨水直至过量;
②在明矾溶液中加入氢氧化钡溶液直至过量;
③在含少量氢氧化钠的偏铝酸钠溶液中通入二氧化碳直至过量;
④在少量盐酸的氯化铝溶液中加入氢氧化钠至过量。
在4个图像,纵坐标为沉淀物质的量,横坐标为溶液中加入物质的物质的量,上述实验与图像对应关系正确的是( )
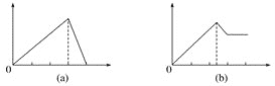
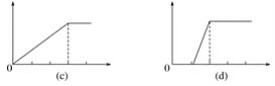
A.①-(d)B.②-(b)C.③-(c)D.④-(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.4.0g重水(D2O)中所含质子数为0.4NA
B.4.48L N2与CO的混合物中所含分子数为0.2NA
C.常温下,7.1g Cl2与足量NaOH溶液反应转移的电子数约为0.1NA
D.0.2mol Na2O2中含有离子总数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
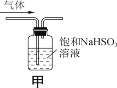
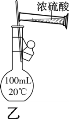
A.可用干燥的pH试纸测量氯水的pH
B.蒸干FeCl3溶液制无水FeCl3固体
C.用装置甲除去SO2中的少量HCl
D.用装置乙配制100 mL 0.50 mol·L-1硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多含氮物质会造成环境污染,硝酸工业的尾气(含NO、NO2)会造成大气污染,通常用选择性非催化还原法或碱液吸收法[石灰乳吸收,既能净化尾气,又能获得应用广泛的Ca(NO2)2]。而废水中过量的氨氮(NH3和NH4+)会导致水体富营养化,则通常用强氧化剂来吸收。
(1)废气中氮氧化物的吸收。
①选择性非催化还原法。发生的主要反应有:
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1
4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1
2NO(g)+(NH2)2CO(s)+![]() O2(g)
O2(g)![]() 2N2(g)+2H2O(g)+CO2(g) ΔH=-780.02 kJ·mol-1
2N2(g)+2H2O(g)+CO2(g) ΔH=-780.02 kJ·mol-1
则2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)的ΔH=__________。
CO(NH2)2(s)+H2O(g)的ΔH=__________。
②碱液吸收法。该工艺中采用气液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),得到的滤渣可循环使用,该滤渣的主要成分是________(填化学式)。 工艺需控制NO和NO2物质的量之比接近__________,若小于这个比值,则会导致_______________。
(2)废水中过量的氨氮(NH3和NH4+)处理。某科研小组用NaClO氧化法处理氨氮废水。
已知:A.HClO的氧化性比NaClO强;
B.NH3比NH4+更易被氧化;
C.国家标准要求经处理过的氨氮废水pH要控制在6~9。
进水pH对氨氮去除率的影响如下图所示。
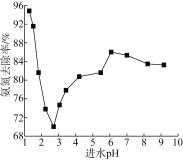
①进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是___________。
②写出酸性条件下ClO-氧化NH4+的离子方程式____________________。
③已知a.O2的氧化性比NaClO弱; b.O2氧化氨氮速率比NaClO慢。
在其他条件不变时,仅增加单位时间内通入空气的量,氨氮去除率_______________(填“显著变大”“显著变小”或“几乎不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。不仅可以制备物质,还可以提纯和净化。
(1)电解食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示,图中的阳离了交换膜只允许阳离子通过,请回答以下问题:
①图中A极要连接电源的_______(填“正”或“负”)极
②精制饱和食盐水从图中_____位置补充,氢氧化钠溶液从图中_____位置流出。(选填“a”“b” “c” “d” “e”或“f”)

③电解总反应的离子方程式是_____________。
(2)化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图所示

①电源正极为____(填A或B),阴极反应式为_____________。
②若电解过程中转移了5mol电子,则膜左侧电解液的质量变化为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. HCl与NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 燃烧热是指1mol物质完全燃烧时放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化如图所示(某些反应条件和部分反应产物已略去)。
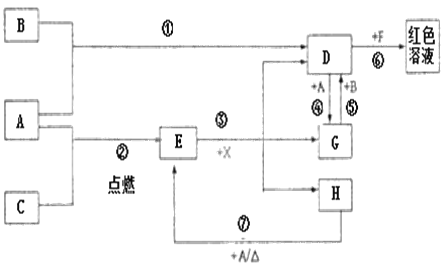
(1)写出下列物质的化学式:D___,X___。
(2)在反应①~⑦中,不属于氧化还原反应的是___(填数字编号)。
(3)反应⑥的离子方程式为:___。
(4)反应⑦的化学方程式为___;该反应中每消耗0.3mol的A,可转移电子___mol。
(5)除去D溶液中混有的少量G的方法是:___。
(6)检验G溶液中阳离子的方法是:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com