
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为:Zn﹣2e﹣+2OH﹣=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性减弱
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是_____________、____________________;
(2)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y、Z是原子序数依次增大的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z的最外层电子数之比为2∶3;常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞溶液变红。请回答下列问题:
(1)Z 元素在元素周期表中的位置是______________ ,化合物A2X2的电子式为______________
(2)化合物A2X和A2Z中,沸点较高的是__________(填化学式),其主要原因是_____________
(3)A与X、A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为:_______
(4)将Z与X 形成的气态化合物ZX2通入Ba(NO3)2 溶液中,有白色沉淀和NO气体生成,发生反应的离子方程式为___________________
(5)两种均含A、X、Y、Z四种元素的化合物相互反应放出气体的反应离子方程式为:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秸秆(含多糖类物质)的综合利用具有重要的意义.下面是以秸秆为原料合成聚酯类高分子化合物的路线: 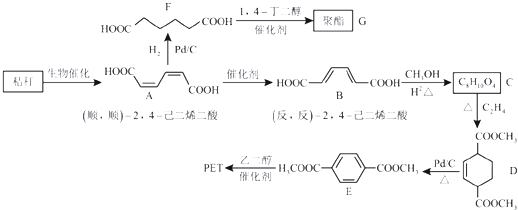
回答下列问题:
(1)下列关于糖类的说法正确的是 . (填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为 .
(3)D中的官能团名称为 , D生成E的反应类型为 .
(4)F的化学名称是 , 由F生成G的化学方程式为 .
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5molW与足量碳酸氢钠溶液反应生成44gCO2 , W共有种(不含立体异构),其中核磁共振氢谱为三组峰的结构简式为 .
(6)参照上述合成路线,以(反,反)﹣2,4﹣已二烯和C2H4为原料(无机试剂任选),设计制备对苯二甲酸的合成路线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C三种有机物的有关信息:
A | ①能使溴的四氧化碳溶液褪色;②比例模型为: ③能与水在一定条件下反应生成C |
B | ①由C、H、O三种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应; ③能与B反应生成相对分子质量为88的酯 |
请结合信息回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式____________________________,反应类型为______________。
(2)A与氢气发生加成反应后生成物质D,写出符合下列要求的有机物的结构简式:_______。
①与D互为同系物 ②分子中碳原子总数是4 ③分子里带有一个支链
(3)对于物质B有关说法正确的是_____ (填序号) 。
①无色无味液体 ②有毒 ③易溶于水 ④具有酸性,能与碳酸钙反应 ⑤官能团是-OH
(4)写出在浓硫酸作用下,B与C反应生成酯的化学方程式________________________________。
(5)下列试剂中,能用于检验C中是否含有水的是______ (填序号)。
①CuSO4·5H2O ②无水硫酸铜 ③浓硫酸 ④金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季是流感多发季节,最近我校许多学生得了流感,表现症状为发热头痛等,乙酰苯胺是磺胺类药物具有很好退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:
![]()
己知:①苯胺易被氧化:
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。

实验步骤如下:
步骤1:在50mL烧瓶中加入9mL(0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,依照上图装置组装仪器。
步骤2:控制温度计示数约105℃,小火加热回流1h。
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
步骤4:将步骤3所得粗产品进一步提纯后,称得产品质量为10.8g。
请回答下列问题:
(1)步骤1中加入锌粉的作用是________________________________。
(2)步骤2加热可用_________________(填“水浴”或“油浴”)
(3)锥形瓶所接的蒸馏物是______________(填化学式)。实验这样设计的目的是__________________。
(4)步骤2中,控制温度计读数在105℃左右的原因_______________,得到的粗产品需进一步提纯,该提纯方法是________________________________________________________。
(5)纯净的乙酰苯胺为无色片状晶体,对无色片状晶体进行干燥,判断晶体干燥完全的实验方法是___________________________________________。
(6)请计算所得到乙酰苯胺的产率是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx在阳光的作用下会引起光化学烟雾,从而造成严重的大气污染。火力发电厂烟气中含有大量氮氧化物,必须对燃烧后的烟气进行处理,其原理如下(已知:燃烧系统排放烟气中的NOx,90%以上是NO):
![]()
请回答:
(1)NO2气体的颜色为______。
(2)下列物质可作试剂A的是______(填字母)。
a.O3 b.CO c.NH3 d.ClO2
(3)试剂B可使用Na2SO3溶液,该反应的化学方程式为______。
(4)NO2还可以用NaOH溶液吸收(原理:2NO2+2NaOH===NaNO2+NaNO3+H2O)。取一定量 NO2用过量的V1 mL c1 mol·L1NaOH溶液吸收完全,剩余NaOH用V2 mL c2 mol·L1 H2SO4溶液恰好中和,则被吸收的NO2物质的量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是环保部门监测有害气体常用的一种药品,它易溶于水,遇酸易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图。

实验具体操作步骤为:
①打开分液漏斗使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
(1)写出仪器A的名称____。
(2)写出A中发生反应的化学方程式____。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是____。
(4)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42离子,该反应的离子方程式为____。
(5) 为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下图装置进行实验。

①实验装置的连接顺序依次是____(填装置的字母代号),装置C中的试剂为____。
②能证明固体中含有碳酸钠的实验现象是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com