
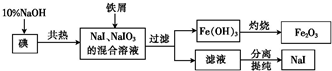
分析 由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,应的离子方程式为2Fe+IO3-+3H2O=2Fe(OH)3↓+I-,过滤后得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI,
(1)碘与NaOH溶液反应生成NaI、NaIO3;
(2)加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,Fe元素的化合价升高,I元素的化合价降低;
(3)25℃时已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合溶液显酸性,酸的物质的量大,说明高碘酸为弱酸,NaIO4溶液中高碘酸根离子水解显碱性.
解答 解:由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,过滤后得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI,
(1)碘与NaOH溶液反应生成NaI、NaIO3,离子反应为3I2+6OH-=5I-+IO3-+3H2O,故答案为:3I2+6OH-=5I-+IO3-+3H2O;
(2)由2Fe+IO3-+3H2O=2Fe(OH)3↓+I-,Fe元素的化合价升高,I元素的化合价降低,氧化剂为NaIO3,还原剂为Fe,由反应可知,氧化剂与还原剂的物质的量之比为1:2,故答案为:1:2;
(3)25℃时已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合溶液显酸性,说明高碘酸溶液中存在电离平衡,说明高碘酸为弱酸,NaIO4溶液中高碘酸根离子为弱酸根离子水解显碱性,
故答案为:碱性.
点评 本题考查制备实验,为高频考点,把握制备流程中发生的反应及操作为解答的关键,涉及氧化还原反应及pH的计算等,注重基础知识的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (a+b)×63g | B. | (a+b)×169g | C. | [Vc-$\frac{9a+b}{3}$]mol | D. | (a+b)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示的装置,接通电源5min后,电极3的质量增加了0.64g.
如图所示的装置,接通电源5min后,电极3的质量增加了0.64g.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在②的溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+) | |
| B. | 四种溶液中离子总数的关系:④>③>②>① | |
| C. | 四种溶液中c(H+)的关系:①>②>③>④ | |
| D. | 在①的溶液中:c(H+)=c(HA-)+c(A2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用有少量蒸馏水的容量瓶配制溶液 | |
| B. | NaOH溶解后未冷却到室温即转移至容量瓶 | |
| C. | 移液后烧杯未用蒸馏水洗涤 | |
| D. | 定容时俯视液面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com