
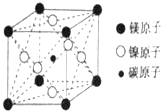
 最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )| A. | MgCNi3 | B. | Mg2CNi3 | C. | MgCNi2 | D. | MgC2Ni |
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:多选题
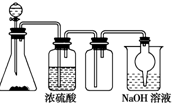 如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是
如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是| A. | MnO2和浓盐酸 | B. | Na2SO3(s)和较浓H2SO4 | ||
| C. | Cu片和浓HNO3 | D. | 浓氨水和生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于第二周期且相邻,W是非金属元素,其中基态Y原子的2p轨道处于半充满状态,基态W原子的3p能级上有一个未成对电子.含U的化合物的焰色为紫色.试回答下列问题:
X、Y、Z、W、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于第二周期且相邻,W是非金属元素,其中基态Y原子的2p轨道处于半充满状态,基态W原子的3p能级上有一个未成对电子.含U的化合物的焰色为紫色.试回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素基态原子核外共有7种运动状态不同的电子 | |
| B. | 该元素位于周期表的S 区,属于金属元素 | |
| C. | 该元素在周期表中的位置第四周期第VA族 | |
| D. | 该元素M层含有11个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com