
| 选项 | A | B | C | D |
| 物质 | 浓硫酸 | 汽油 | 小苏打 | 硝酸钾 |
| 标识 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Y的体积分数减小 | D. | X的转化率下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
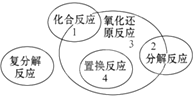 四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | H2+Cl2 $\frac{\underline{\;点燃\;}}{\;}$ 2HCl | ||
| C. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | D. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com