
分析 (1)根据1个硫酸分子中有2个氢原子,可求出C(H+);根据Kw计算C(OH-);
(2)溶质的物质的量浓度C=$\frac{n}{V}$;结合Kw=[H+][OH-],pH=-lg[H+]计算;依据溶液稀释过程溶质的物质的量不变计算.
解答 解:(1)0.05mol/L硫酸溶液中,C(H+)═2c(SO42-)=0.1mol/L,则pH=-lgC(H+)═1;则C(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=10-13mol/L;
故答案为:1;0.1;10-13;
(2)0.04g氢氧化钠的物质的量为$\frac{0.04g}{40g/mol}$=0.001mol,溶于水配制成100mL溶液物质的量浓度C=$\frac{0.001mol}{0.1L}$=0.01mol/L,氢氧化钠为强碱,则溶液中氢氧根离子浓度c(OH-)=10-2mol/L,常温下Kw=10-14,依据Kw=[H+][OH-],C(H+)=$\frac{1{0}^{-14}}{1{0}^{-2}}$=10-12mol/L,则溶液pH=-lg10-12=12;
从该溶液中取出1毫升加水稀释至1000升,溶液的体积增大了106倍,碱溶液稀释不能显酸性,只能接近中性,所以溶液的pH大约为7;
故答案为:0.01mol/l;12;7.
点评 本题考查了有关物质的量浓度、溶液pH值的计算,熟悉计算公式是解题关键,注意稀释过程中溶质的物质的量不变,题目难度中等,侧重于考查学生对基础知识的应用能力和计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量为36.5g | |
| B. | 含有6.02×1023个HCl分子 | |
| C. | 标准状况下的体积为44.8 L | |
| D. | 溶于1L水后,溶液中H+浓度为2mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a | b | c |  |
| A | Cu | CuO | Cu(OH)2 | |
| B | SiO2 | Na2SiO3 | H2SiO3 | |
| C | AlCl3 | NaAlO2 | Al(OH)3 | |
| D | CaO | Ca(OH)2 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
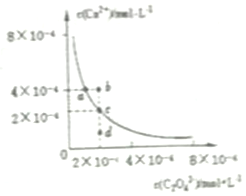
| A. | 向CaC2O4饱和溶液中加入固体Na2C2O4可以由a点变到b点 | |
| B. | 通过蒸发可以由d点变到c点 | |
| C. | d点无CaC2O4沉淀生成 | |
| D. | a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、CO、CO2都是极性分子 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | 分子晶体熔点越高,其稳定性越增强 | |
| D. | CS2、H2O、C2H2都是直线形分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反产生的气体通入溴的四氯化碳溶液 |
| B | 检验卤代烃中卤原子的种类 | 将溴乙烷与氢氧化钠溶液共热,取冷却后反应液 滴加硝酸酸化后滴加硝酸银溶液 |
| C | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| D | 验证苯和液溴在FeBr3的催化下发生取代反应 | 将反应产生的混合气体先通入溴的四氯化碳溶液再通入AgNO3溶液中,观察是否有淡黄色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com