
| A、1mol单质Fe与足量H2O(g)反应,转移的电子数为2NA | B、10mL pH=6的纯水中含有OH-离子数为10-10NA | C、1mol羟基中含有电子数为9NA | D、100mL 1mol?L-1 的Na2CO3溶液中含有CO32-离子数为0.1NA |
| 8 |
| 3 |
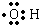 )中含有9个电子,1mol羟基中含有9mol电子;
)中含有9个电子,1mol羟基中含有9mol电子;| 8 |
| 3 |
| 8 |
| 3 |
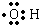 ,1mol羟基中含有9mol电子,含有电子数为9NA,故C正确;
,1mol羟基中含有9mol电子,含有电子数为9NA,故C正确;

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| A、1mol Cl2全部溶于水转移电子的数目为2NA | B、1mol PX(对二甲苯)中含有C-H键的数目为6NA | C、25℃时1L pH=12的氨水中含有的NH4+数目小于0.01NA | D、14g C2H4、C3H6的混合气体中含有碳原子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1mol甲基(-CH3)所含的电子数为10 NA | B、在标准状况下,11.2L NO与11.2L O2混合后气体分子数为0.75NA | C、88g干冰中含有的共用电子对数为8NA | D、25℃时,pH=11的Na2CO3的水溶液中水所电离出来的H+数为10-3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2L N2和NO的混合气体所含的原子数 | B、1mol Cl2参加化学反应获得的电子数 | C、1L 1mol/L CH3COOH溶液中所含分子总数 | D、28g铁在反应中作还原剂时,失去电子的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,5.6L CCl4含有的C-Cl共价键数为NA | B、2.4g Mg与足量稀硫酸反应时,失去电子数为0.1NA | C、l L0.5mol.L-1 CuCl2 溶液中含有的 Cu2+数为0.5NA | D、16g氧气和臭氧的混合物中氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L CH3OH中含有分子的数目为0.5NA | B、在密闭容器中加入1.5mol H2和0.5mol N2,充分反应后可得到NH3分子数为NA | C、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA | D、常温常压下,18g H2O含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46g NO2和N2O4混合气体中含有的分子总数为NA | B、用含4mol HCl的浓盐酸跟足量二氧化锰反应生成的氯气在标准状况下的体积为22.4L | C、0.1mol金属钠与氧气在一定条件下发生反应,生成钠的氧化物的混合物时,失去的电子数为0.1NA | D、1mol苯中含有3NA个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4L NH3中含氮原子数为 NA | B、1 mol Na2O2与水完全反应时转移的电子数为NA | C、1 L 0.1mol?L-1碳酸钠溶液的阴离子总数小于0.1 NA | D、1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
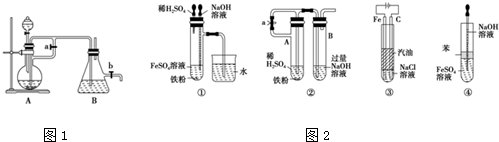
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com