
| A. | 氨气具有还原性,可用作制冷剂 | |
| B. | 氢氟酸具有弱酸性,可用于蚀刻玻璃 | |
| C. | 浓硫酸具有脱水性,可用于干燥CO2 | |
| D. | 二氧化氯具有强氧化性,可用来漂白织物 |
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题

| A. | Y电极附近溶液中产生白色浑浊 | |
| B. | 电池工作时Na+向正极移动 | |
| C. | 废液的pH大于NaClO溶液的pH | |
| D. | X电极上发生的反应为:ClO-+H2O+2e-═Cl-+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
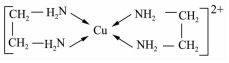
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为78,中子数为117的铂原子:78117Pt | |
| B. | Al3+的结构示意图: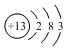 | |
| C. | 次氯酸钠的电子式: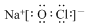 | |
| D. | 碳酸的电离方程式:H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
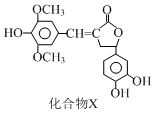
| A. | 每个X分子中含有1个手性碳原子 | |
| B. | 化合物X能使酸性高锰酸钾溶液褪色 | |
| C. | 1 mol化合物X最多能与5 mol NaOH发生反应 | |
| D. | 化合物X与溴水既能发生加成反应又能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使淀粉-KI溶液变蓝的溶液:H+、NH4+、Fe2+、Br- | |
| B. | 滴入酚酞呈红色的溶液:Na+、Ca2+、CH3COO-、Cl- | |
| C. | 滴入苯酚显紫色的溶液:Mg2+、NH4+、Cl-、SCN- | |
| D. | 滴入甲基橙呈红色的溶液:K+、Na+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-11的溶液:Na+、Ba2+、NO3-、CI- | |
| B. | 0.5mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、CI- | |
| C. | 1.0mol•L-1的HNO3溶液:NH4+、[Ag(NH3)2]+、Cl-、SO42- | |
| D. | 使pH试纸显深蓝色的溶液:Na+、Mg2+、NO3-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳基硫的电子式: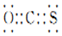 | |
| B. | 乙醛分子的比例模型: | |
| C. | 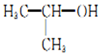 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | |
| D. | 氢化钠与重水反应的化学方程式:NaH+D2O═NaOH+D2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2-… |
| A. | 第①组反应的其余产物为H2O | |
| B. | 第③组反应中生成1molCl2,转移电子4mol | |
| C. | 氧化性由强到弱顺序为MnO4->Fe3+>Cl2>Br2 | |
| D. | 第②组反应中Cl2与FeBr2的物质的量之比可能为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com