
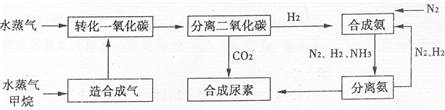
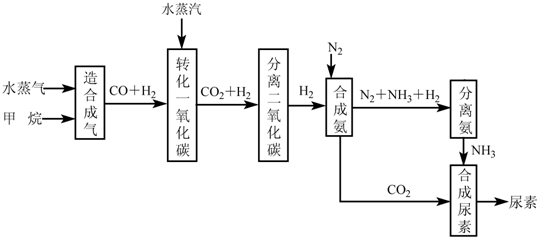
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化
步骤及生成物未列出):
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
CO(g)+3H2(g);△H>0在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)B D (选对1个得1分,只要选错得0分)(2)不变;>(3)A
(4)2:1;有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用 (5)4.8×108
解析试题分析:(1)根据反应的方程式可知,该反应是体积增大的吸热的可逆反应,则在恒温恒容的条件下,欲提高CH4的反应速率和转化率,可采取的措施是升高温度或增大水蒸气的浓度。增大压强平衡向逆反应方向移动。充入He气,容器容积不变,平衡不移动,答案选BD。
(2)平衡常数只与温度有关系,则提高氢碳比平衡常数不变。
H2O(g) +CO(g)  H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol/L) 1 1 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) 1-x 1-x x x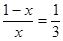 ,解得x=0.75
,解得x=0.75
则此时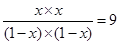 <9.94
<9.94
所以此时v(正)大于v(逆)。
(3)催化剂不能改变平衡常数,B不正确;合成氨反应温度控制在500℃左右,因为在该温度下,催化剂的活性最大,C不正确;合成氨工业采用循环操作的主要原因是为了提高原料的的利用率,D不正确,所以正确的答案选A。
(4)根据尿素的化学式CO(NH2)2可知,理论上n(NH3)∶n(CO2)的最佳配比为2:1;实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用。
(5)根据反应的方程式可知,CH4 ~4H2 ~ 8/3NH3
1 8/3
3.0×108 L×0.6 4.8×108L
考点:考查甲烷的应用、尿素合成的有关判断和计算
点评:化学来源于生产、生活,又服务于生产、生活,合成氨工业是初中化学重要的应用之一,是考查重点,常涉及化学方程式的书写,原料的利用率的计算等,有利于培养学生的逻辑推理能力和发散思维能力。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2014届江苏省扬州市高二下学期期末调研测试化学试卷(解析版) 题型:填空题
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):

(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
提高氢碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1∶3,此时v(正) v(逆)(填“>”、“=”或“<”)。
(3)有关合成氨工业的说法中正确的是 。
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3)∶n(CO2)的最佳配比为 ,而实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为 。
(5)当甲烷合成氨气的转化率为60%时,以3.0×108 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com