
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。判断下列说法中,正确的是( )
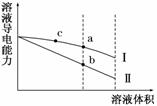
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的p H由大到小顺序为a>b>c
H由大到小顺序为a>b>c
C.a点的KW值和b点的KW相等
D.a点水电离的c(H+)大于c点水电离的c(H+)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
将AlCl3、FeCl2、FeCl3、MgCl2四种溶液,只用一种试剂就能加以区别,这种试剂是
A.HCl B.NaOH C.BaCl2 D.KSCN
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质加入足量水,形成悬浊液,一段时间后,加入过量盐酸,浑浊部分消失且有无色无味气体生成的是( )
A.Ba(NO3)2和Na2SO3 B.BaCO3和Na2SO4
C.BaCl2和Na2SO4 D.Ca(HCO3)2和Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2SO2(g)+O2(g)2SO3(g) ΔH=-a kJ·mol-1(a>0)。恒温恒容下,在10 L的密闭容器中加入0.1 mol SO2和0.05 mol O2,经过2 min达到平衡状态,反应放热0.025 a kJ。下列判断正确的是( )
A.在2 min内,v(SO2)=0.0025 mol·L-1·min-1
B.若再充入0.1 mol SO3,达到平衡后SO3的质量分数会减小
C.在1 min时,c(SO2)+c(SO3)=0.01 mol·L-1
D.若恒温恒压下,在10 L的密闭容器中加入0.1 mol SO2和0.05 mol O2,平衡后反应放热小于0.025a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工业的核心反应是:N2(g)+3H2(g)2NH3(g) ΔH=Q kJ·mol-1,能量变化如 下图,回答下列问题:
下图,回答下列问题:
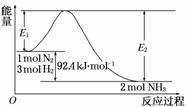
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”、“减小”或“不变”)。
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量________ 46.2 kJ(填“<”、“>”或“=”)。
(3)关于该反应的下列说法中,正确的是________。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率________。若升高温度,K值变化________(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中,欲提高合成氨中H2的转化率,下列措施可行的是________(填字母)。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.分离出氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是( )
A.2CN-+H2O+CO2===2HCN+CO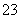
B.2HCOOH+CO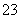 ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN,消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO 、SO
、SO 、Na+
、Na+
B.水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO
C.c(H+)/c(OH-)=1012的水溶液中:NH 、Al3+、NO
、Al3+、NO 、Cl-
、Cl-
D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO 、SCN-
、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
选择下列实验方法分离提纯物质,将分离提纯方法的序号填在横线上。
A.萃取分液 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1)________分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(3)________分离水和汽油的混合物。
(4)________分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
(5)________除去混在乙烷中的乙烯。
(6)________提取碘水中的碘。
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
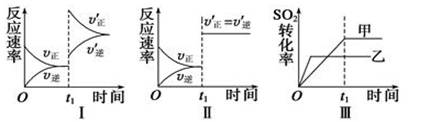
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com