
【题目】二氧化硫的催化氧化原理为2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是 ( )
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是 ( )

A. 在D点时v 正<v逆
B. 反应2SO2(g)+O2(g)![]() 2SO3(g)为放热反应
2SO3(g)为放热反应
C. 若B、C点的反应速率分别为vB、vC,则vB<vC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法不正确的是:

A. 氮元素均被氧化
B. 工业合成氨属于人工固氮
C. 含氮无机物和含氮有机物可相互转化
D. 碳、氢、氧三种元素也参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )

A. 溶液中一定不含CO32﹣,可能含有SO42-和NO3-
B. 溶液中n(NH4+)="0.2" mol
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)︰n(Al3+)︰n(Mg2+)=1︰1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y、Z是短周期元素,原子序数依次增大。X的原子序数是R的2倍,R的原子最外层电子数是X的2倍。Z的最高价氧化物对应的水化物(M)是强电解质,向Y的钠盐溶液中滴加M溶液,产生沉淀的物质的量与M的物质的量关系如图所示。下列推断正确的是

A. R的氢化物可能使溴水或酸性高锰酸钾溶液褪色
B. Y的气态氢化物热稳定性比R的强
C. 常温常压下,Z的单质一定呈黄绿色
D. X和Z组成的化合物属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单斜硫和正交硫转化为二氧化硫的能量变化如下图所示。下列说法正确的是( )

A. 由图可知,单斜硫转化为正交硫的反应为吸热反应
B. 正交硫比单斜硫性质活泼
C. 相同条件下,等量的正交硫比单斜硫所含有的能量低
D. 相同条件下,生成等量的二氧化硫气体,正交硫放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(1)B装置的作用是_________________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有____________气体产生,写出D中发生反应的离子方程式______________________。若去掉C,能否得出同样结论____________(填“是”或“否”) ,原因是____________________________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
___________________________ | ________________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,则x、y和z应满足的关系为________________________。
(5)结合上述实验现象,完成硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,可采用还原法处理尾气中NO,其原理:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
实验 | c(NO)/mol·L-1 | c(H2)/mol·L-1 | v(正)/mol·L-1·min-1 |
① | 0.10 | 0.10 | 0.414k |
② | 0.10 | 0.40 | 1.656k |
③ | 0.20 | 0.10 | 1.656k |
下列有关推断正确的是
A. 上述反应中,正反应活化能大于逆反应活化能
B. 若升高温度,则k(正)增大,k(逆)减小
C. 在上述反应中,反应级数:m=2,n=1
D. 在一定温度下,NO、H2的浓度对正反应速率影响程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧锂离子电池的正极材料,主要成分为 LiCoO2(难溶于水)还含有 Al以及少量 Ca、Mg、Cu、Fe 等。制备 Co3O4 微球的工艺流程如下:
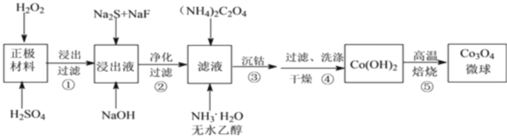
回答下列问题:
(1)LiCoO2 中 Co 元素的化合价为______。
(2)配平步骤①中生成 Co2+的离子方程式为_____LiCoO2 +____H++_____H2 O2 =_____Co2++_____O2 ![]() +_____Li++_____H 2O此过程中若用浓盐酸代替 H2SO4 和 H2O2的混合溶液,除因挥发使其利用率降低外,还有的缺点是_____。
+_____Li++_____H 2O此过程中若用浓盐酸代替 H2SO4 和 H2O2的混合溶液,除因挥发使其利用率降低外,还有的缺点是_____。
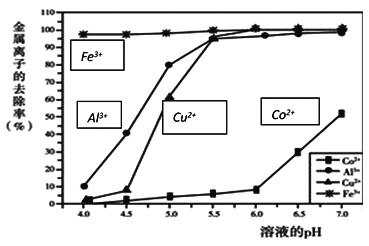
(3)步骤②中,不同 pH 下溶液中金属离子的去除效果如下图所示。该过程加入NaOH调节溶液 pH 的最佳范围是______,理由是______。
(4)步骤④中,过滤、洗涤操作均需用到的玻璃仪器有烧杯、玻璃棒、_____。
(5)步骤⑤中,Co(OH)2 在空气中高温焙烧生成 Co3O4 的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com